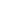芳基氟化反应
发表时间:2023-02-16芳基氟化反应
简介
芳基含氟砌块是指一系列拥有一个或几个直接连接到芳环骨架上的氟原子的芳香族化合物。当氟引入芳烃时,可以提供许多优异的特性。首先,氟化芳烃比非氟化芳烃亲脂性更强,这可以在药物开发中得到利用,提高药物分子的脂溶性,可增强含氟药物分子在生物体内对膜、组织的穿透能力,从而提高生物体内的吸收和传输速度。此外,在药物化学中,氟有时被用作氢的电子等排体(氢和氟的空间参数相似,范德华半径分别为1.2 ?和1.35 ?)。除此之外,含氟化合物还可以战略性地被用作过渡态抑制剂。

图1.芳基含氟砌块
由于氟自身特殊的性质,无论采用什么方法,任何生成C-F键的反应都是一个重大的挑战。氟化物阴离子,由于其电负性和小的离子半径(1.33 ?),可以与各种氢键供体如水、醇、胺和酰胺形成强氢键。氟离子在水介质中的高溶解性会导致其周围有一个紧密结合的水分子水合层。因此,在有氢键供体的情况下,氟化物通常只有微弱的亲核性,而氟化物的这种弱亲核性限制了通过亲核取代反应生成C-F键。
芳烃氟化方法
传统的亲核芳烃氟化反应
关于传统亲核芳烃氟化反应的一个主要挑战是对相对简单的底物的限制,这是由苛刻的反应条件和亲核氟化物的强毒性造成的。1927年,Balz和Schiemann通过伯芳香胺通过四氟硼酸重氮中间体经过热分解转化为芳基氟化物[1,2],开辟了芳烃的亲核氟化反应(图2)。
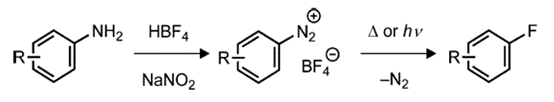
图2.芳基重氮盐的亲核氟化
该反应在概念上类似于Sandmeyer反应,将重氮盐转化为其他芳基卤化物(ArCl、ArBr)[3]。然而,尽管Sandmeyer反应涉及铜试剂/催化剂和自由基中间体,但四氟硼酸重氮的热分解在没有助催化剂的情况下进行,生成高度不稳定的芳基阳离子(Ar+),从而提取来自BF4?的F?,得到氟芳烃(ArF)以及作为副产物的三氟化硼。
亲核氟化反应
亲核氟化是一种简单而有效的芳烃亲核氟化的方法,排除了水和其他会减弱氟化物亲核性的氢键供体。四丁基氟化铵(TBAF)是一种商业易得,易溶于有机溶剂的亲核试剂,可作为三水合物使用(图3)。
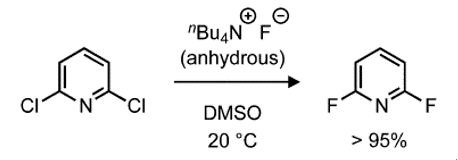
图3.使用TBAF的亲核芳烃氟化
酚类的亲核脱氧氟化
除了芳基卤化物,苯酚是合成芳基氟化物更易反应且更易获得的底物。例如,邻苯二酚可以先进行脱氧氟化,然后用硼氢化钠还原(图4)。
图4.通过一锅反应对邻苯二酚进行脱氧氟化
亲电氟化反应:
与上述芳基氟化互补的方法是使用芳基亲核试剂和亲电氟化试剂。N-F氟化试剂在形式上可以作为氟离子的来源,常用的亲电氟化试剂如图5所示。
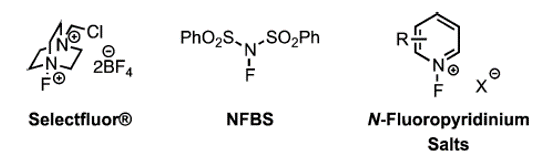
图5.常用的亲电氟化试剂
其中,Selectfluor(N-氟-N'-(氯甲基)三乙二胺双(四氟硼酸盐)或F-TEDA)是一种用户友好、温和、空气和水分稳定、非挥发性的亲电氟化试剂。Selectfluor试剂能够在一个步骤内将氟引入有机底物,同时具有非常广泛的反应性[4]。此外,这些反应均表现出良好的区域选择性。
使用Selectfluor氟化试剂完成了一种强效和无细胞毒性的丙型肝炎病毒RNA复制核苷抑制剂的合成(图6)。与母体2'-C-甲基腺苷相比,这种核糖苷显示出明显的酶学稳定性[5]。

图6.使用Selectfluor的亲电氟化试剂
应用
芳基含氟砌块被广泛用作合成药物的中间体或药物分子,其中氟取代可以通过影响pKa、调节构象、疏水相互作用和亲脂性或这些属性的叠加来提高药效和对靶标的选择性。除此之外,芳基含氟砌块还可以应用于杀虫剂、塑料和与液晶技术有关的分子中。
参考文献
1.Balz, Günther; Schiemann, Günther (1927). "über aromatische Fluorverbindungen, I.: Ein neues Verfahren zu ihrer Darstellung" [Aromatic fluorine compounds. I. A new method for their preparation.]. Chemische Berichte (in German). 60 (5): 1186–1190. https://doi.org/10.1002/cber.19270600539
2.Furuya, Takeru; Klein, Johannes E. M. N.; Ritter, Tobias (2010). "C–F Bond Formation for the Synthesis of Aryl Fluorides". Synthesis. 2010 (11): 1804–1821. https://doi.org/10.1055/s-0029-1218742
3.Swain, C. G.; Rogers, R. J. (1975). "Mechanism of formation of aryl fluorides from arenediazonium fluoborates". J. Am. Chem. Soc. 97 (4): 799–800. https://doi.org/10.1021/ja00837a019
4.Singh, R. P. , Shreeve, J. M.. 2004. For a review of recent highlights: Acc. Chem. Res..37, 31.
5.Eldrup AB, Prhavc M, Brooks J, Bhat B, Prakash TP, Song Q, Bera S, Bhat N, Dande P, Cook PD, et al. 2004. Structure?Activity Relationship of Heterobase-Modified 2’-C-Methyl Ribonucleosides as Inhibitors of Hepatitis C Virus RNA Replication. J. Med. Chem.. 47(21):5284-5297.
https://doi.org/10.1021/jm040068f