【阿拉丁】Triton X-114相分离法去除蛋白样品内毒素(LPS)
发表时间:2025-09-111.目的:
利用Triton X-114的温度依赖性相分离特性,有效去除水溶性蛋白样品中的内毒素(脂多糖,LPS),同时保留目标蛋白在水相中。
2.原理:
Triton X-114在低温(0–4°C)时完全溶于水,形成均一溶液;加热至其浑浊点(cloud point,~22°C)以上时,溶液发生相分离,形成密度较大的去污剂相和密度较小的水相。疏水性的内毒素倾向进入去污剂相,而大多数亲水性蛋白保留在水相中。离心可加速相分离,收集水相即获得低内毒素蛋白。
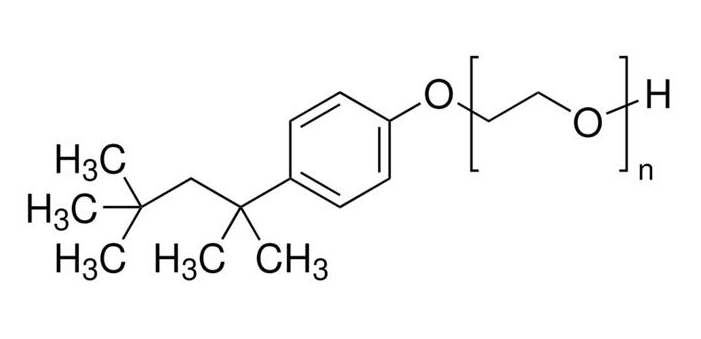
图一 Triton X-114化学结构式
3.材料与试剂
含内毒素的蛋白样品(如重组蛋白、抗体)
低内毒素级Triton X-114(T101474)
低内毒素缓冲液(PBS P397924、Tris-HCl T301491等),pH适宜蛋白稳定
冰浴(0–4°C)
可控温水浴(30–37°C)
预冷离心机
离心管(1.5 mL、15 mL等,根据样品体积选择)
移液器及低吸附移液枪头
4.仪器设备
温控离心机
精准水浴或恒温加热块
冰桶
5.实验前准备
预冷设备:将离心机转头及离心管置于4°C预冷。
配制Triton X-114储备液:将低内毒素Triton X-114溶解在低内毒素缓冲液中,配制10–20%(w/v)储备液,澄清后储存4°C。
样品缓冲液兼容性:避免高甘油、蔗糖、强变性剂或其他去污剂,必要时进行透析或稀释。
6.操作步骤
步骤1:加入Triton X-114并混匀
将Triton X-114储备液加入蛋白样品中,轻柔混匀,形成均一透明溶液,使Triton 与内毒素充分接触。操作温度保持在0–4°C,立即混匀。注意避免产生气泡,保证混合均匀。
步骤2:冷孵育
在0–4°C冰浴中孵育5–15分钟,使Triton X-114与内毒素充分作用。确保冰浴温度稳定,以达到最佳效果。
步骤3:热孵育诱导相分离
将样品转移至30–37°C水浴中孵育5–10分钟,直至溶液出现浑浊,形成去污剂微滴和水相,实现LPS分配。温度需精确控制,保证相分离效果。
步骤4:离心分离
在30–37°C条件下,10,000–15,000×g离心5–10分钟,加速相分离。离心后溶液通常分为三层:上层水相(含目标蛋白)、下层去污剂相(含内毒素)、界面层(含杂质)。注意温度需与热孵育保持一致。
步骤5:收集水相
小心吸取上层水相,转移至干净预冷离心管,通常回收90–95%的体积。避免扰动下层和界面层,以减少杂质污染。
步骤6:去除残留Triton X-114(可选)
如对Triton敏感,可重复步骤1到步骤5两到四次,或使用超滤、透析(选用适当MWCO膜)或专用树脂吸附,降低Triton残留。
步骤7:验证
对处理后的蛋白样品进行内毒素检测(LAL法)、蛋白浓度测定(BCA或Bradford法)以及蛋白活性或结构完整性检测,确保实验效果。
7.注意事项与优化建议
|
类别 |
说明 |
建议与提示 |
|
Triton X-114纯度 |
低内毒素级Triton必须使用 |
避免污染样品 |
|
温度控制 |
冷孵育与热孵育/离心温度需精确 |
精准水浴、温控离心机 |
|
缓冲液组成 |
盐浓度和pH需适宜蛋白稳定 |
避免高浓度甘油、蔗糖、强变性剂 |
|
Triton浓度 |
通常2%最佳,可根据蛋白调整1–4% |
可根据蛋白特性优化 |
|
多次循环 |
提高内毒素去除率,降低残留Triton |
可重复2–4次 |
|
界面处理 |
吸水相时避免吸入界面层 |
减少杂质污染 |
|
疏水蛋白 |
可能分配至去污剂相 |
预估回收率降低,必要时优化条件 |
|
安全操作 |
Triton对皮肤和眼睛有刺激 |
戴手套和护目镜,通风操作 |
8.总结
Triton X-114相分离法是一种经济、有效的亲水性蛋白去内毒素方法。成功关键在于:低内毒素Triton X-114、精确温控、界面小心操作、多次循环及最终内毒素检测。
阿拉丁:https://www.aladdin-e.com/