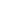基于纳米颗粒的基因传递----阿拉丁试剂
发表时间:2023-08-31

在基因传递中,载体在DNA(亲水,带负电)通过细胞膜(疏水,带负电)的过程中是必不可少的。此外,治疗效率还取决于DNA有效地递送到靶部位。由于系统中存在许多传递障碍,如细胞内摄取、内体逃逸、DNA释放和核摄取等,以及细胞外屏障,如避免颗粒清除机制、靶向特定组织和/或感兴趣的细胞、保护DNA免受降解等,因此开发一种高效且生物相容性好的基因传递系统非常重要。到目前为止,基因传递系统可分为两大类,即病毒转导系统和非病毒转染系统。尽管病毒可用于基因传递,但其携带的DNA体积大、装载能力低、大规模制造、质量控制成本、免疫原性和潜在的致癌性等缺点限制了病毒载体在基因传递中的应用。
因此,研究人员已将注意力转向开发非病毒载体,作为传递基因的替代载体。非病毒传递系统有几个明显的优点,包括易于制备,适于聚合物性质的合成操作, 细胞或组织靶向性,低免疫原性和致癌性,无病毒重组,不受携带DNA大小的限制,制造成本低。此外,非病毒载体由于其大小、电荷和结构修饰载体的优点, 可以很容易地将遗传物质传递到靶细胞。
其中,纳米材料是基因传递的理想材料,因为其物理性质使其适合于特定的功能。无机纳米材料因其易于功能化、独特的电学和光学特性、生物相容性以及低细胞毒性而备受追捧。磁性纳米颗粒、金纳米颗粒、量子点和碳纳米管是常用的无机材料,用于传递基因。
磁性纳米颗粒
磁感染是一种基于磁性纳米颗粒(MNPs)与基因载体关联的程序,可以在磁场存在下增强基因转移。它最初是由Christian Plank和他的同事开发的,他们通过使用MNPs-DNA复合物或MNPs病毒载体复合物在细胞培养和体内转移基因。过程很简单:将MNPs-DNA复合物添加到贴壁细胞的培养物中,并将磁铁靠近烧瓶或平板的底部,将磁性复合物吸引到底部,在那里它们与细胞密切接触并被物理内化,对内吞摄取机制没有任何特殊的磁力影响。在体内,在靶部位添加磁场会增加转染量,并将治疗基因靶向到体内的特定器官/位置。一般来说,我们通过静脉注射带有治疗基因的颗粒,并在靶部位施加高梯度的外部磁铁来捕获颗粒。一旦被捕获,这些颗粒就会被滞留在目标部位,然后被组织吸收。
金纳米粒子
金纳米颗粒(AuNPs)是一种稳定、均匀、具有生物相容性的金属纳米颗粒,具有独特的电子结构、尺寸相关的强度显示、高度可调的电子、磁性和光电子特性, 使其成为基因传递的理想选择。此外,AuNPs的软表面化学性质使它们能够与各种生物分子和配体进行定制。例如,Klibanov等人将~2 kDa 聚乙烯亚胺(PEI)链共价连接到AuNPs上,将质粒DNA载体传递到哺乳动物细胞中。他们发现,最有效的偶联物在质粒DNA传递方面的效率是未经修饰的PEI对偶物的12倍(图1)。AuNPs的另一个重要特征是其金属核心构建块。这种结构为治疗材料提供了坚实的支撑,使这些材料即使在无限稀释后也能保持稳定。
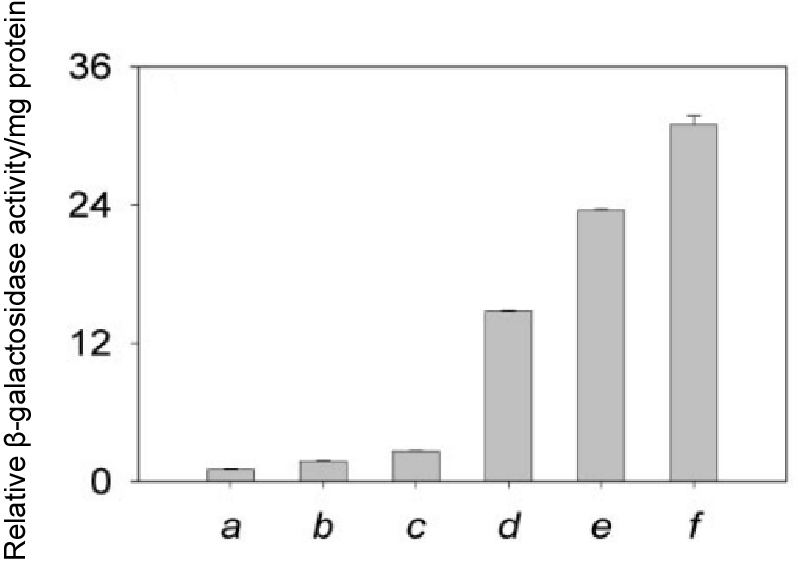
图 1:在不同N/P比下,COS-7细胞培养中β-gal基因在血清存在下由PEI2(图 a-c)和PEI2 - gnpii(图 d- f)介导的表达程度。对于a,d,N/P=90; 对于b,e, N/P=120;对于c,f,N/P=150。
量子点
量子点(QD)是基于半导体的单分散纳米晶体,可以通过胶体或等离子体合成机制等不同方法制备。由于其光学和电学性质,量子点是一种有吸引力的无机材料。量子点的大小与它们的吸收和基因传递效率直接相关。例如,Yang等人通过在单个点上涂覆PEI合成了多个QD(MQD)束。这些MQD结合编码增强型绿色荧光蛋白(pEGFP)的质粒DNA分子(pDNA),然后有效地将该pDNA传递到人间充质干细胞(hMSCs)中。他们发现,在几个不同大小的QD中,QD655 是覆盖PEI/pDNA的最大QD,转染效率最高。QD655的荧光强度比使用QD525 的结果高60%(图 2)。这表明使用量子点进行基因传递是针对难以穿透的干细胞的另一种有吸引力的方法。
图 2:多个QD捆绑NPs转染hMSCs的裸鼠体内生物成像。(A)皮下注射多个
QD捆绑NPs转染hMSCs的小鼠体内光学成像:a)对照组,b)合并图像,c- f)移植区域图像,c)多个QD525捆绑NPs,d)多个QD565捆绑NPs,e)多个QD605捆绑NPs,f)多个QD655捆绑NPs与pDNA复合物;(B)(A)中荧光信号的定量;(C)多个QD捆绑NPs转染hMSCs移植区荧光信号(a-d)和共聚焦荧光图像(e-h)的定量:多个QD525捆绑NPs(a和e),多个QD565捆绑NPs(b和f),多个QD605捆绑NPs(c和g),多个QD655捆绑NPs处理组(d和h)。
碳纳米管
考虑到缺乏对内源性酶的稳定性,较差的药代动力学特征,以及固有的无法横过质膜的能力,它对核酸在体内的治疗递送是一个挑战。碳纳米管(Carbon nanotubes,CNTs)已被广泛应用,包括用于基因治疗的核酸递送。CNTs需要对其外表面进行化学调整,以便在各种应用中最大限度地发挥其独特的性能。CNTs 具有独特的长径比,是化学功能化策略和生物相容性的理想模板,这使其成为分子转运系统的有希望的候选者。此外,经过表面功能化后,CNTs在水介质中的溶解度增加, 在体内和体外的生物相容性和传递核酸的倾向都得到改善。因此,具有表面修饰的CNTs是一系列核酸的理想递送系统。Munk等人评估了羧酸功能化多壁碳纳米管(COOH-MWCNTs)的细胞毒性及其将编码绿色荧光蛋白基因的质粒 DNA传递到牛原代成纤维细胞的用途。流式细胞术细胞活力结果显示低浓度COOH-MWCNTs 的无毒性。拉曼光谱的频移表明质粒DNA与纳米材料相连。荧光成像、流式细胞术和PCR分析证实COOH-MWCNT成功将pDNA 导入原代成纤维细胞。结果表明,COOH-MWCNTs是将DNA递送到难以转染的原代牛细胞的有吸引力的替代方案。
参考文献
1.KC, R. B., Thapa, B., & Bhattarai, N. (2014). Gold nanoparticle-based gene delivery: promises and challenges. Nanotechnology Reviews, 3(3), 269-280.
2.Majidi, S., Zeinali Sehrig, F., Samiei, M., Milani, M., Abbasi, E., Dadashzadeh, K., & Akbarzadeh, A. (2016). Magnetic nanoparticles: Applications in gene delivery and gene therapy. Artificial cells, nanomedicine, and biotechnology, 44(4), 1186-1193.
3.Prabu, S. L., Suriyaprakash, T. N. K., & Thirumurugan, R. (2017). Medicated nanoparticle for gene delivery. In Advanced Technology for Delivering Therapeutics. IntechOpen.
4.Thomas, M., & Klibanov, A. M. (2003). Conjugation to gold nanoparticles enhances polyethylenimine's transfer of plasmid DNA into mammalian cells. Proceedings of the National Academy of Sciences, 100(16), 9138-9143.
5.Bates, K., & Kostarelos, K. (2013). Carbon nanotubes as vectors for gene therapy: past achievements, present challenges and future goals. Advanced drug delivery reviews, 65(15), 2023-2033.
6.Riley, M. K., & Vermerris, W. (2017). Recent advances in nanomaterials for gene delivery—a review. Nanomaterials, 7(5), 94.
7.Yang, H. N., Park, J. S., Jeon, S. Y., Park, W., Na, K., & Park, K. H. (2014). The effect of quantum dot size and poly (ethylenimine) coating on the efficiency of gene delivery into human mesenchymal stem cells. Biomaterials, 35(29), 8439-8449.
8.Munk, M., Zanette, R. D. S. S., de Almeida Camargo, L. S., de Souza, N. L. G. D., de Almeida, C. G., Gern, J. C., ... & de Mello Brand?o, H. (2017). Using carbon nanotubes to deliver genes to hard-to-transfect mammalian primary fibroblast cells. Biomedical Physics & Engineering Express, 3(4), 045002.