阿兹海默症信号通路----阿拉丁试剂
发表时间:2023-06-14
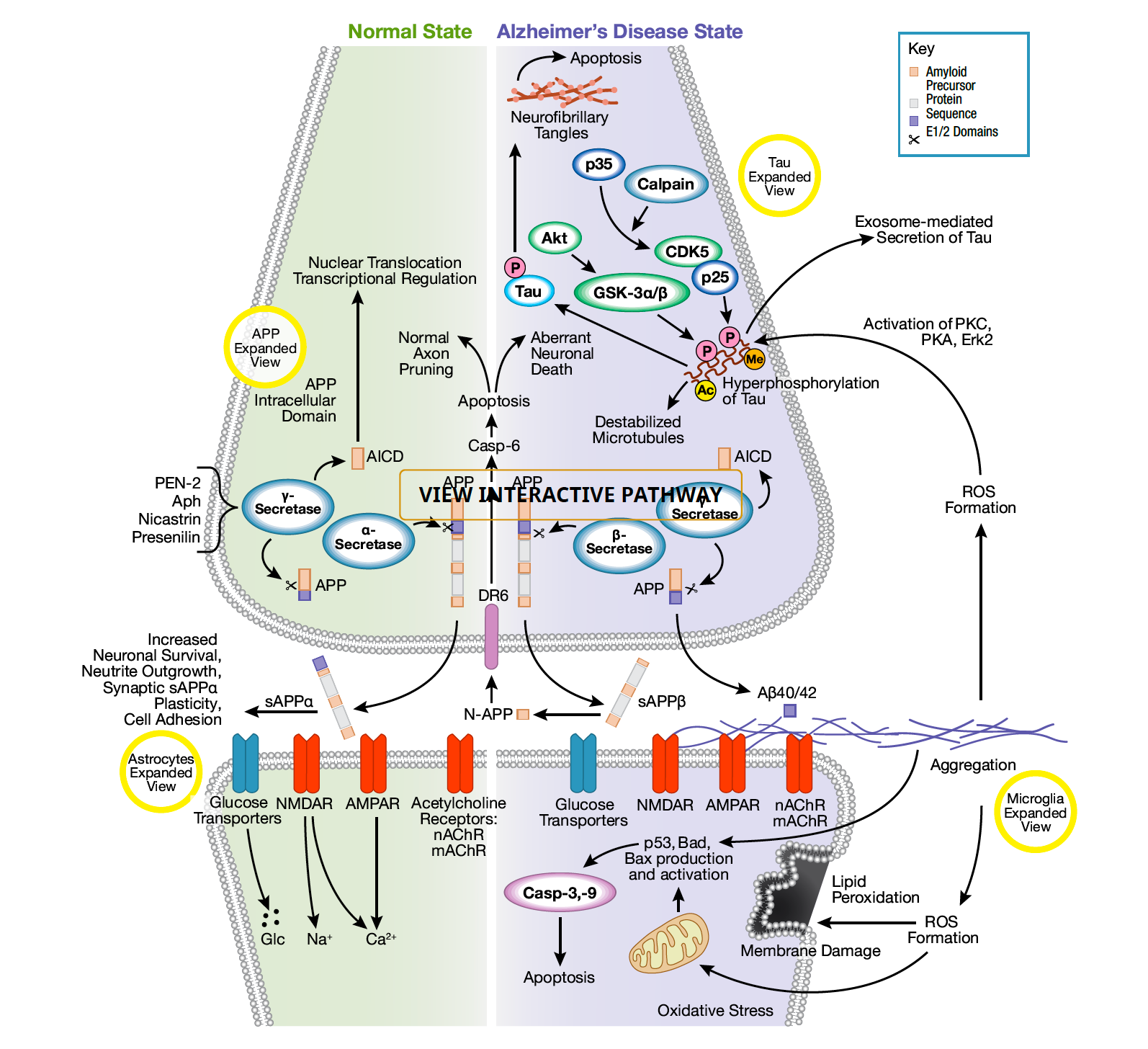
图1.阿兹海默症分子与细胞生物学原理
阿尔茨海默病是世界上最常见的神经退行性疾病之一。临床表现为细胞外淀粉样斑块和细胞内神经纤维缠结,导致神经元功能障碍和细胞死亡。这种疾病的核心是淀粉样前体蛋白(APP)的差异加工。APP是一种完整的膜蛋白,经过蛋白水解处理。APP最初被α-分泌酶裂解,生成sAPPα和C83羧基端片段。sAPPα的存在与正常的突触信号传递有关,并调节神经元存活和突触可塑性等过程,这些过程有助于学习和记忆等更高阶的大脑功能,以及其他行为。APP也可以被β-分泌酶和γ-分泌酶依次裂解,释放出不同大小的胞外单体,其中最重要的是Aβ40/42。在疾病状态下,APP处理途径之间的不平衡导致神经毒性单体聚集增加,产生Aβ寡聚和斑块形成。致病性Aβ聚集导致离子通道阻塞、钙稳态破坏、线粒体氧化应激、能量代谢受损和葡萄糖调节异常、突触功能改变,最终导致神经元细胞死亡。一些胶质细胞类型,包括星形胶质细胞和小胶质细胞,在淀粉样单体、寡聚物和斑块积聚的背景下,被认为是神经保护和致病的。阿尔茨海默病的另一个特点是存在神经原纤维缠结,它由微管相关蛋白Tau的过度磷酸化形式组成。GSK-3α/β和CDK5是主要负责Tau磷酸化的激酶,尽管其他激酶如PKC, PKA和Erk2也参与其中。Tau蛋白的过度磷酸化导致Tau蛋白从微管分离,随后是微管失稳和Tau蛋白的寡聚,最终导致细胞内的神经纤维缠结。这些缠结的逐渐积累导致神经元凋亡。
虽然阿兹海默症给人类的神经系统健康带来巨大的威胁,但目前也只有少数药物得到批准可用于该疾病的治疗。并且这类药物的作用通常只是控制症状,很难改变疾病的进程。通过对大量的病例及临床结果的研究与总结,研究人员也提出了各种不同的理论来阐述阿兹海默病的发病过程,其中广为接受并开展药物设计与研究的主要有以下几种:β-淀粉样蛋白假说 (Amyloid cascade hypothesis) 、Tau蛋白假说 (Tau hypothesis) 和胆碱能假说 (Cholinergic hypothesis) 等。阿拉丁可为您提供近百种用于阿兹海默症研究治疗的活性化合物。
参考文献
1. Bossy-Wetzel E, Schwarzenbacher R, Lipton SA (2004) Molecular pathways to neurodegeneration. Nat. Med. 10 Suppl, S2–9.
2. Chen JX, Yan SS (2010) Role of mitochondrial amyloid-beta in Alzheimer's disease. J. Alzheimers Dis. 20 Suppl 2, S569–78.
3. Claeysen S, Cochet M, Donneger R, Dumuis A, Bockaert J, Giannoni P (2012) Alzheimer culprits: cellular crossroads and interplay. Cell. Signal. 24(9), 1831–40.
4. Marcus JN, Schachter J (2011) Targeting post-translational modifications on tau as a therapeutic strategy for Alzheimer's disease. J. Neurogenet. 25(4), 127–33.
5. Müller WE, Eckert A, Kurz C, Eckert GP, Leuner K (2010) Mitochondrial dysfunction: common final pathway in brain aging and Alzheimer's disease--therapeutic aspects. Mol. Neurobiol. 41(2-3), 159–71.
6. Nizzari M, Thellung S, Corsaro A, Villa V, Pagano A, Porcile C, Russo C, Florio T (2012) Neurodegeneration in Alzheimer disease: role of amyloid precursor protein and presenilin 1 intracellular signaling. J Toxicol 2012, 187297.
7. Thinakaran G, Koo EH (2008) Amyloid precursor protein trafficking, processing, and function. J. Biol. Chem. 283(44), 29615–9.
8. Guo, T., Zhang, D., Zeng, Y., Huang, T. Y., Xu, H., & Zhao, Y. (2020). Molecular and cellular mechanisms underlying the pathogenesis of Alzheimer’s disease. Molecular Neurodegeneration 15.
9. Lane, C. A., Hardy, J., & Schott, J. M. (2018). Alzheimer’s disease. European Journal of Neurology 25(1), 59–70.