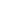企业动态
通过生物正交点击反应制备多功能细胞培养支架
发表时间:2022-12-30

简介
在组织工程和再生医学领域,设计能够以三维方式再现活组织复杂细胞外本质的生物材料支架是一项具有挑战性的要求。水凝胶是一类被广泛研究和开发的合成型细胞外基质模拟物(ECM),由于其高含水量、足够的弹性和易于转移的特性,因此适合在2D和3D环境中细胞培养,并作为在模拟软组织环境中一些关键力学性能测试的载体[1-5]。
一般来说,水凝胶可以通过各种天然和合成的前驱体来制备得到,这些前驱体可以通过物理、离子或共价相互作用交联[2]。当细胞在这样的体系中被培养时,由天然聚合物形成的水凝胶能够为其提供大量的生物信号(例如:细胞粘附蛋白、生长因子库、蛋白质降解域),但在其结构上通常缺乏灵活性,以重复单元的结构组成,来控制最终获得材料的理化性质。此外,由合成大分子形成的水凝胶可以精确控制在组织工程上的一些关键参数,如力学、膨胀和降解,但通常这些化学成分是细胞无法识别的。因此,人们对开发合成凝胶作为细胞载体和培养体系的研究方向越来越感兴趣,这样的体系能够有效整合合成材料和天然材料的优点。本文将基于聚乙二醇(PEG)水凝胶的研究进展讨论其中涉及到的一些概念。聚乙二醇水凝胶已被广泛应用于2D和3D细胞培养,各种方法和理论被用于控制聚乙二醇凝胶的性质和整合细胞信息[3-5]。更重要的是,聚乙二醇材料能够有效减少非特异性蛋白质的相互作用,使研究人员能够更好地了解细胞如何从细胞外部环境接收特定信号。
聚乙二醇水凝胶合成的化学和分子设计原理
通常在含水条件下,PEG水凝胶是由共价或非共价交联的线性或支链/星型聚合物链形成的。物理交联的聚乙二醇(PEG)和聚环氧丙烷嵌段共聚物由于具有较低的临界溶解温度(LCST)(≈37℃),通过原位形成水凝胶而得到了广泛的应用[6];然而,这些通过非共价键组装而成的水凝胶的力学强度通常较弱。为此,研究者们发现了一种新的替代方法,即通过共价交联法来构建高稳定性的PEG水凝胶[2]。为了建立用于细胞培养的共价交联网络,还必须注意所选取的交联方法的细胞相容性。在这项研究中,两种聚合机理被广泛使用:(i)链式增长;(ii)阶梯式增长[4,5]。末端官能化的PEG的链聚合是稳定且简单的[4],但是它的网络构成复杂,结构具有一定的异构性,动力学链长度分布宽,且它的降解仅限于网络交联点。近期,聚乙二醇的阶梯式增长聚合机理成为一种更为简便的方法,可以实现可控的、更均匀的交联聚合物网络,同时提供了引入生物信号的简单途径。通常,对基于PEG的阶梯增长水凝胶,会采用以化学计量的方式使用双官能化的分子交联多官能化的分子系统;一般来说,形成凝胶的基本条件是其平均官能度必须大于2。根据所需的网格大小或交联密度,这些分子中的任何一种或两种都可以从基于PEG的聚合物中衍生出来(图1)。针对3D细胞培养和组织再生的水凝胶,能够适用于生理条件和高效、无毒的化学交联方法都是关键的必要条件,因为凝胶通常需要在有细胞和蛋白质存在的情况下形成。这些复杂性促使生命科学家们探索各种化学反应,以形成温和和具特异性的水凝胶,但其反应条件仍需保持在适当的生理pH值和温度下进行。
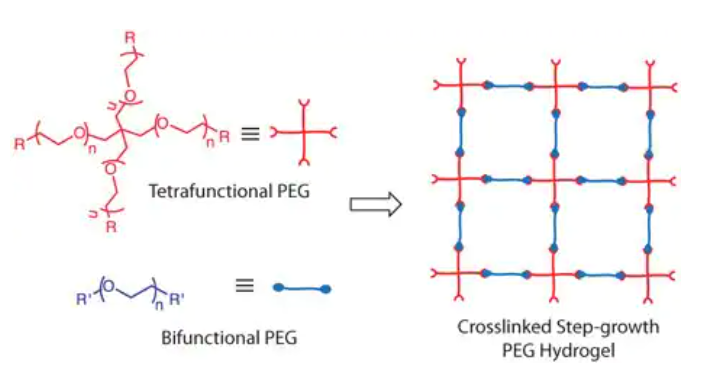
图1:4臂和线性PEG前驱体的结构;以及通过这些PEG大分子形成的阶梯式生长水凝胶的示意图。
在结构复杂但明确的支架中的点击化学反应
最近在生物材料领域带来重大进展的化学策略之一是“点击化学”,由Sharpless和他的同事提出,并获得了2022年的诺贝尔化学奖,用于描述在水溶液条件下连接两个分子组分的快速、高选择性和高产率的反应[7]。虽然铜催化的叠氮炔环加成反应(CuAAC)(图2A)是最早被发现的点击反应,但后来发现了多种化学反应,包括Michael加成反应(图2B)、光引发的硫醇-烯反应(图2C)、Staudinger连接反应和应变促进的叠氮化物-炔基环加成反应(SPAAC),以实现点击化学的概念[7-9]。由于这组反应不仅相互正交,而且在生物系统中与功能基团正交,它们已经成为生物材料科学家构建控制良好、高度明确的复杂材料支架的优越化学工具。
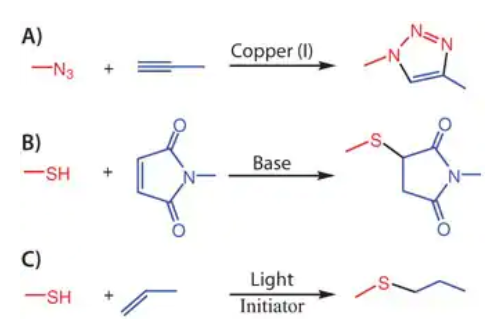
图2:常见的点击反应:A)铜催化叠氮炔环加成;B)碱催化硫醇与马来酰亚胺的Michael加成反应;C)光引发硫醇-烯偶联反应。
在以上对聚乙二醇水凝胶和点击化学的介绍之后,本文的剩余部分将集中在:(i)利用各种点击反应构建用于细胞培养的聚乙二醇水凝胶,以及(ii)如何利用点击反应的正交性,通过选择性生物表达精确功能化这些材料,用以指导细胞功能。
MICHAEL加成反应
由于反应条件温和、反应速度快,迈克尔型的加成反应是在细胞存在的情况下形成水凝胶材料的绝佳点击反应。这种类型的反应是由于硫醇盐阴离子(迈克尔供体)亲核进攻α,β-不饱和酮(迈克尔受体)的缺电子双键而进行的(图2B)。乙烯基砜、马来酰亚胺和丙烯酸酯都是广泛用于形成水凝胶的迈克尔受体。Hubbell和他的团队[10,11]是第一批使用4臂聚乙二醇乙烯基砜和半胱氨酸侧翼肽(图3)开发阶梯式增长水凝胶并且用于细胞培养的团队之一。由于硫醇到硫醇盐阴离子的去质子化对这些反应至关重要,需要通过添加碱来拔氢,Hubbell团队通过简单地调节缓冲液的pH值来解决这个问题。这种合成路径使他们能够在不需要额外修饰的情况下合并半胱氨酸多肽。通过这种方法,他们证明了许多肽表位可以控制细胞粘附(例如:Arg-Gly-Asp-Ser (RGDS)、Ile-Lys- Val-Ala-Val (IKVAV)),以及一种纤溶蛋白敏感肽交联剂,可以被细胞分泌的蛋白酶降解。Garcia团队报道了马来酰亚胺功能化的多臂PEG,使用了极低浓度的碱基交联二巯基肽交联剂,具有更快的反应动力学,这在封装更敏感的细胞类型时提供了额外的帮助。
图3:通过Michael加成,在4臂聚乙二醇四聚乙烯基砜和半胱氨酸末端功能化的MPP可切割肽之间形成阶梯生长的水凝胶。
THIOL-ENE反应
与迈克尔加成反应(即阴离子反应)不同,Thiol-ene反应通过自由基机制进行,其中硫基自由基可以加成到缺少电子或富含电子的碳-碳双键(称为-烯)上[8]。典型的Thiol-ene反应机理包括(图4A):(i)通过自由基引发从硫醇中获取氢原子,(ii)由此产生的硫基与烯烃官能团结合形成碳基,(iii)碳基链转移到另一个硫醇上,再次得到硫基,然后再生成新的烯烃。虽然硫基可以从热、光和氧化还原引发剂中生成,但光引发剂对于细胞相关的应用格外具有吸引力,因为与细胞兼容的光引发条件已被广泛报道[8],而且还允许使用者从空间和时间维度控制反应。
另外有研究小组报道了用光引发Thiol-ene化学方法用于合成肽功能化的聚乙二醇水凝胶[13]。在这个方法中(图4),基于生理环境的pH条件下,使用苯基锂-2,4,6-三甲基苯甲酰膦酸盐(LAP)作为水溶性光引发剂,在PBS缓冲液中用365-420 nm波长的光,将降冰片功能化的多臂聚乙二醇和含有凝乳胰蛋白酶可裂解肽的半胱氨酸通过交联制备聚乙二醇水凝胶。凝胶的形成条件和形成的水凝胶体系都具有较高水平的细胞活性(>95%)。更重要的是,由于这种化学反应是基于光的,在凝胶的特定位置,细胞信号(如细胞粘附RGDS)的光模式得以实现(图4),这最终决定了局部细胞的相互作用关系和形态。这种在水凝胶支架上的任何硫代细胞信号元件(如硫代蛋白)在细胞封装后都容易结合,使实验人员有可能从长远的时间维度上理解和指导细胞功能(如细胞分化)。在类似的研究中,巯基-丙烯酸酯聚合也被用于合并巯基亲和肽,这些肽将某些细胞生存蛋白保留在支架[14]以及模拟细胞相互作用的蛋白[15]中,从而整合ECM的额外功能特性。
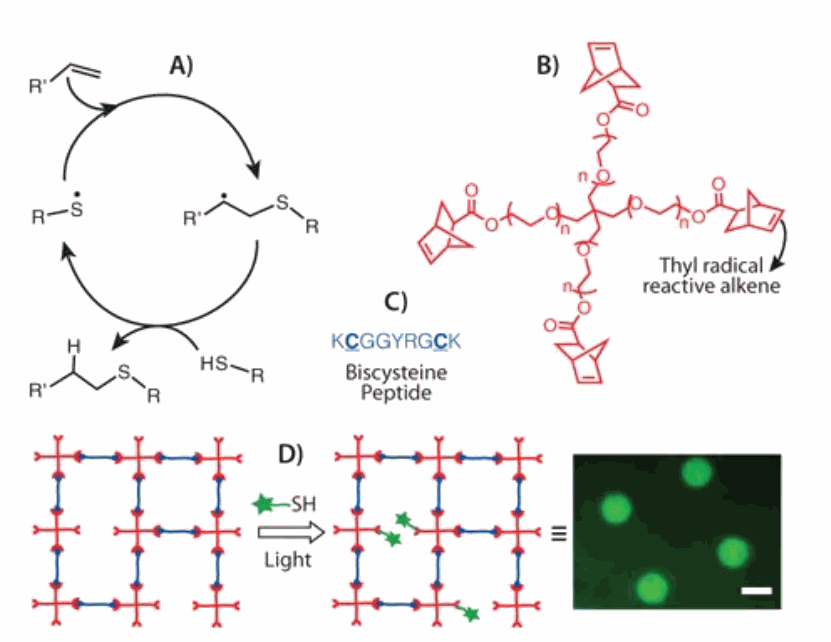
图4:Thiol-ene光化学:A)Thiol-ene反应的一般机理;B)常用烯——4臂聚乙二醇四降冰片烯的结构;C)含凝乳蛋白酶可裂解肽交联剂的半胱氨酸;D)Thiol-ene聚合形成的光模式网络示意图,通过非化学计量反应网络,在水凝胶支架内的特定位置偶联巯基细胞粘合剂配体;用Alexafluor488标记RGD的光刻成像图,比例尺:500 μm。
应变促进的叠氮化物-炔基环加成(SPAAC)反应
在各种点击反应中,铜(I)催化叠氮化物-炔基环加成(CuAAC)形成1,2,3-三唑(图2A)已经被广泛应用,无论是材料科学还是生物医学科学。因为叠氮化物、炔和三唑在各种反应条件和大多数生物系统中基本上是稳定的,不与其他各组分发生反应。虽然这种点击反应是在经典的Huisgen环加成反应中引入铜(I)催化剂之后才流行起来的,但这种过渡金属的毒性很大程度上限制了它在生物系统中的应用。特别是对于细胞培养应用,CuAAC生产的水凝胶只是作为预制的细胞培养基质,而无法作为细胞封装支架来使用[16, 17],同时它还要作为水凝胶支架中出现依序点击反应技术的发起点[18]。
为了克服CuAAC的这一局限性,Bertozzi与其同事率先开发了在环炔和叠氮化物之间进行的应变促进的叠氮化物-炔环加成(SPAAC)(图5),该反应无需铜催化剂,使其成为更适用于细胞封装的理想生物正交反应[9],从无铜点击化学的概念出发,通过4臂PEG四叠氮(图6A)和二环基化的基质金属蛋白酶(MMP)可降解肽合成了PEG水凝胶[19,20]。在这个研究中,凝胶使用可降解肽交联,从而实现了网络的降解和重塑,同时这取决于细胞分泌的MMPs。例如,由于存在吸电子的氟以及特征性的环应变,所以这里用到了反应动力学速率更快的DIFO[9,19](图5)。在有细胞存在的生理条件下,凝胶化过程在不到5分钟内即可发生。
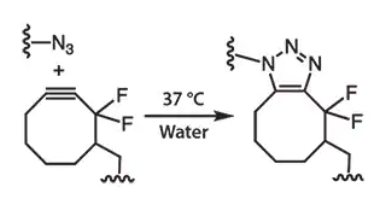
图5:叠氮化物与DIFO之间的SPAAC消除了反应对铜催化剂的需要,并能够在生理环境下发生。
依序点击反应
在许多生物学应用中,人们通常希望在特定的时间点以及空间限定的区域引入相关功能信号线索。这些信号可能包括生存线索(例如整合素结合分子)、生长因子(例如隔离细胞因子的亲和配体)或细胞特异性降解位点(例如用于释放信号或允许细胞运动的MMP可裂解连接子)。这导致了连续点击反应的出现:使用一次点击化学反应形成凝胶,随后使用另外的点击化学反应以一种时空控制的方式去修饰它。由于Thiol-ene化学反应是由光驱动的,因此它已成为一种强大而通用的方法,以实现在PEG水凝胶细胞壁龛中明确和高度复杂结构的引入。
利用SPAAC和Thiol-ene点击反应之间的正交性:该研究小组已经证明了可以通过SPAAC形成PEG水凝胶(图6A),然后使用Thiol-ene点击化学来控制发生反应的时间和空间位置,在这种情况下,肽交联剂携带一个垂悬的烯丙基(图6A),以允许凝胶后结构的光照反应仍然是有效的[19],在这种水凝胶基质中包裹的细胞不仅可以表达>90%的细胞活力,而且对图形化的生化线索有反应。例如,细胞形态和黏附空间的控制是通过在凝胶的特定位置绘制RGD肽图建立的(图6A)。同样的,当自我淬灭的二荧光素胶原酶裂解肽(裂解后荧光增强)经光照射后,在胶原酶活性高的区域即细胞周围能够观察到更强的荧光,从而可以实现实时观察到细胞的局部活性。
近期,该研究团队同样利用正交光耦联和光裂解反应实现了生物相关线索的依序模式化和去模式化(图6B和6C)[21]。通过使用含有硝基苯醚连接体[21-23]的巯基化RGD肽,利用不同波长的光对偶联和裂解行为进行控制,从而实现光裂解(图6D),随后我们可以在水凝胶内特定位置对人间充质干细胞(hMSC)群进行外部粘附和分离(图6B和6C)。这种对水凝胶支架生物化学线索的动态控制不仅使人们能够在空间上控制特定信号和细胞类型的释放,用于再生医学中的细胞递送应用,而且还提供了通过在时空上控制特定和多个线索的呈现来调节干细胞分化的行为。
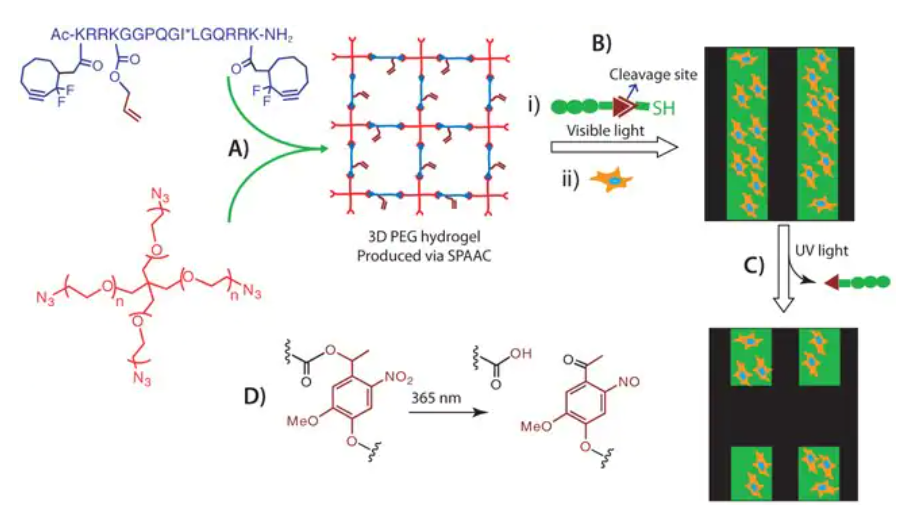
图6:SPAAC水凝胶化学:A)通过利用4臂PEG四叠氮和二环基化的基质金属蛋白酶(MMP)可降解肽通过SPAAC点击化学通过逐步增长的机理形成的3D水凝胶(*显示裂解位点);B)Thiol-ene光修饰SPAAC形成的水凝胶和细胞黏附;C)模式线索的空间移除和由此产生的细胞脱离;D)硝基苯醚光裂解反应。
小结
在过去的十年中,点击化学凭借其便捷、多功能性和生物正交性的特点,在构建用于再生医学应用的复杂材料支架方面起到了重要的作用,彻底改变了用于细胞培养和传递的生物材料支架领域的反应体系[24]。其不仅能够创造多功能性的聚乙二醇水凝胶,并且还开辟了创新的反应途径,如依序点击反应,以时间控制的方式将生化信号嵌入水凝胶支架的特定位置。然而,在这个对于化学背景要求相对较高的领域,特别是在生物材料支架设计中,许多材料开发的创新点还没有出现。例如,虽然这些高效的化学方法已被大量用于从根本上理解和控制细胞特性,包括3D环境中的形态和粘附性,但它们如何用于更好地理解干细胞微环境中的作用机理,并以受控的方式指导其在体外更有效的分化,仍是生物科学家们面临的重大机遇和挑战。
参考文献
1. Peppas N, Hilt J, Khademhosseini A, Langer R. 2006. Hydrogels in Biology and Medicine: From Molecular Principles to Bionanotechnology. Adv. Mater.. 18(11):1345-1360. https://doi.org/10.1002/adma.200501612
2. Lee KY, Mooney DJ. 2001. Hydrogels for Tissue Engineering. Chem. Rev.. 101(7):1869-1880. https://doi.org/10.1021/cr000108x
3. Tibbitt MW, Anseth KS. 2009. Hydrogels as extracellular matrix mimics for 3D cell culture. Biotechnol. Bioeng.. 103(4):655-663. https://doi.org/10.1002/bit.22361
4. Kloxin AM, Kloxin CJ, Bowman CN, Anseth KS. Mechanical Properties of Cellularly Responsive Hydrogels and Their Experimental Determination. Adv. Mater.. 22(31):3484-3494. https://doi.org/10.1002/adma.200904179
5. Zhu J. 2010. Bioactive modification of poly(ethylene glycol) hydrogels for tissue engineering. Biomaterials. 31(17):4639-4656. https://doi.org/10.1016/j.biomaterials.2010.02.044
6. Jeong B, Kim SW, Bae YH. 2002. Thermosensitive sol?gel reversible hydrogels. Advanced Drug Delivery Reviews. 54(1):37-51. https://doi.org/10.1016/s0169-409x(01)00242-3
7. Kolb H, Finn M, Sharpless K. 2001. Angew. Chem. Int.. 40. 2004-2021. https://onlinelibrary.wiley.com/doi/10.1002/1521-3773(20010601)40:11%3C2004::AID-ANIE2004%3E3.0.CO;2-5
8. Hoyle C, Bowman C. 2010. Thiol-Ene Click Chemistry. Angewandte Chemie International Edition. 49(9):1540-1573. https://doi.org/10.1002/anie.200903924
9. Sletten E, Bertozzi C. 2009. Bioorthogonal Chemistry: Fishing for Selectivity in a Sea of Functionality. Angew. Chem. Int. Ed.. 48(38):6974-6998. https://doi.org/10.1002/anie.200900942
10. Pratt AB, Weber FE, Schmoekel HG, Müller R, Hubbell JA. 2004. Synthetic extracellular matrices for in situ tissue engineering. Biotechnol. Bioeng.. 86(1):27-36. https://doi.org/10.1002/bit.10897
11. Lutolf MP, Hubbell JA. 2003. Synthesis and Physicochemical Characterization of End-Linked Poly(ethylene glycol)-co-peptide Hydrogels Formed by Michael-Type Addition. Biomacromolecules. 4(3):713-722. https://doi.org/10.1021/bm025744e
12. Phelps EA, Enemchukwu NO, Fiore VF, Sy JC, Murthy N, Sulchek TA, Barker TH, García AJ. 2012. Maleimide Cross-Linked Bioactive PEG Hydrogel Exhibits Improved Reaction Kinetics and Cross-Linking for Cell Encapsulation and In Situ Delivery. Adv. Mater.. 24(1):64-70. https://doi.org/10.1002/adma.201103574
13. Fairbanks BD, Schwartz MP, Halevi AE, Nuttelman CR, Bowman CN, Anseth KS. 2009. A Versatile Synthetic Extracellular Matrix Mimic via Thiol-Norbornene Photopolymerization. Adv. Mater.. 21(48):5005-5010. https://doi.org/10.1002/adma.200901808
14. Lin C, Anseth KS. 2009. Controlling Affinity Binding with Peptide-Functionalized Poly(ethylene glycol) Hydrogels. Adv. Funct. Mater.. 19(14):2325-2331. https://doi.org/10.1002/adfm.200900107
15. Lin C, Anseth KS. 2011. Cell-cell communication mimicry with poly(ethylene glycol) hydrogels for enhancing -cell function. Proceedings of the National Academy of Sciences. 108(16):6380-6385. https://doi.org/10.1073/pnas.1014026108
16. Malkoch M, Vestberg R, Gupta N, Mespouille L, Dubois P, Mason AF, Hedrick JL, Liao Q, Frank CW, Kingsbury K, et al. 2006. Synthesis of well-defined hydrogel networks using Click chemistry. Chem. Commun..(26):2774. https://doi.org/10.1039/b603438a
17. Liu SQ, Rachel Ee PL, Ke CY, Hedrick JL, Yang YY. 2009. Biodegradable poly(ethylene glycol)-peptide hydrogels with well-defined structure and properties for cell delivery. Biomaterials. 30(8):1453-1461. https://doi.org/10.1016/j.biomaterials.2008.11.023
18. Polizzotti BD, Fairbanks BD, Anseth KS. 2008. Three-Dimensional Biochemical Patterning of Click-Based Composite Hydrogels via Thiolene Photopolymerization. Biomacromolecules. 9(4):1084-1087. https://doi.org/10.1021/bm7012636
19. DeForest CA, Polizzotti BD, Anseth KS. 2009. Sequential click reactions for synthesizing and patterning three-dimensional cell microenvironments. Nature Mater. 8(8):659-664. https://doi.org/10.1038/nmat2473
20. DeForest CA, Sims EA, Anseth KS. 2010. Peptide-Functionalized Click Hydrogels with Independently Tunable Mechanics and Chemical Functionality for 3D Cell Culture. Chem. Mater.. 22(16):4783-4790. https://doi.org/10.1021/cm101391y
21. DeForest CA, Polizzotti BD, Anseth KS. 2009. Sequential click reactions for synthesizing and patterning three-dimensional cell microenvironments. Nature Mater. 8(8):659-664. https://doi.org/10.1038/nmat2473
22. Kloxin AM, Kasko AM, Salinas CN, Anseth KS. 2009. Photodegradable Hydrogels for Dynamic Tuning of Physical and Chemical Properties. Science. 324(5923):59-63. https://doi.org/10.1126/science.1169494
23. DeForest CA, Polizzotti BD, Anseth KS. 2009. Sequential click reactions for synthesizing and patterning three-dimensional cell microenvironments. Nature Mater. 8(8):659-664. https://doi.org/10.1038/nmat2473
24. Nimmo CM, Shoichet MS. 2011. Regenerative Biomaterials that “Click”: Simple, Aqueous-Based Protocols for Hydrogel Synthesis, Surface Immobilization, and 3D Patterning. Bioconjugate Chem.. 22(11):2199-2209. https://doi.org/10.1021/bc200281k