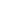用于2D和3D细胞培养的可降解型聚乙二醇水凝胶 简介
发表时间:2022-12-23
简介
随着对多样化功能型生物材料需求的不断增加,组织工程和药物输送等生物技术领域也在持续发展着。几十年来,聚合物生物材料的研究一直集中在测试为其他应用或其加工(如:静电纺丝、溶剂浇铸/致孔剂浸出、3D打印)开发的聚合物的生物相容性。而近期,研究人员已将主要关注方向转向合成专门用于生物医学用途的材料,包括合成蛋白质、糖模拟物和与水性介质相容的聚合物,以及天然聚合物的化学改性(如:通过凝胶化来增加物质在体内的稳定性)。在过去的十年中,聚合物化学家为设计的生物材料创造了一个良好的适用场景,用作于细胞支架或者药物递送。
PEG(聚乙二醇)
聚乙二醇(PEG)是一种亲水性聚合物,当形成交联网络时,能够具备很高的含水量。PEG是适用于生物应用的材料,因为它通常不会引起免疫反应
[6]。自20世纪70年代以来,PEG已被用于修饰治疗性蛋白质和多肽,以增加它们的溶解度,降低其毒性,并延长其循环半衰期[7]。自20世纪70年代末,研究人员便开始尝试使用PEG水凝胶进行细胞培养。聚乙二醇水凝胶具有良好的化学反应性,多种反应性基团可用于其形成水凝胶并且实现高效的化学修饰。PEG大分子单体
通过环氧乙烷的活性阴离子开环聚合能够非常方便地合成聚乙二醇;这些聚乙二醇具有较宽的分子量分布,且包含多种端基(例如:羟基、甲醚基、氨基、N-羟基琥珀酰亚胺(NHS)酯),在众多反应中都可适配。为了形成水凝胶,PEG必须发生交联反应。最开始的时候,PEG是通过电离辐射进行非特异性交联的[8],而现在PEG水凝胶的形成通常是通过共价交联具有反应链端的PEG高分子合成的。
具有活性反应末端的PEG高分子聚合物,如丙烯酸酯、甲基丙烯酸酯、烯丙醚、马来酰亚胺、乙烯基砜、NHS酯和乙烯基醚基团(图1)很容易从现成的一般性材料合成。可在碱存在下使用酸性氯化物(例如:丙烯酰氯、甲基丙烯酰氯)使PEG醇链的末端酯化。PEG链末端可在碱性条件下通过与诸如2-氯乙基乙烯基醚或溴烯丙基等烷基卤化物反应而醚化。PEG二乙烯基砜是通过将PEG偶联到大量过量的二乙烯基砜或通过多步骤工艺来制备氯乙基砜链末端,氯乙基砜链末端可以通过基本消除反应形成的乙烯基砜基团[9]来制备。

形成水凝胶的交联机制取决于PEG高分子链末端的特性。在大多数情况下,是与反应性乙烯基链末端聚合的同时发生交联,通常采用的是自由基引发剂。例如,大分子单体的聚合可以使用通过氧化还原反应生成的自由基(比如过硫酸铵和TEMED)或光照产生的自由基(图2中的Irgacure®651,λ=365 nM)来引发,随后通过丙烯酸酯和甲基丙烯酸酯链末端基元反应来发生链增长。在阶梯生长网络的形成中,多官能度(f>2)的交联剂以化学当量与PEG链末端进行反应,或多官能度的PEG(f>2)也可以与双官能团的交联剂发生交联。丙烯酸酯、甲基丙烯酸酯、乙烯基砜、马来酰亚胺、乙烯基醚和烯丙基醚都可以根据反应条件转化为硫醇,形成阶梯生长网络。典型的交联剂可包括巯基或胺的部分。混合模式聚合是在同一反应容器中发生的两种机制的结果;丙烯酸酯和甲基丙烯酸酯基团可以形成混合模式网络。两种水凝胶形成机制均可用于包裹活体细胞,并且两种机制均可使肽、蛋白质或其他治疗药物发生反应性掺入。
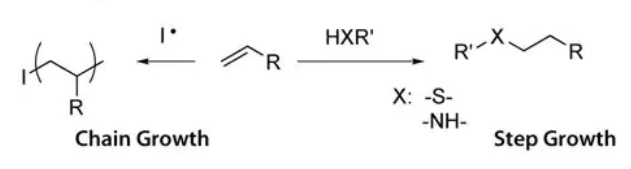
图2:链式增长和阶梯式增长反应
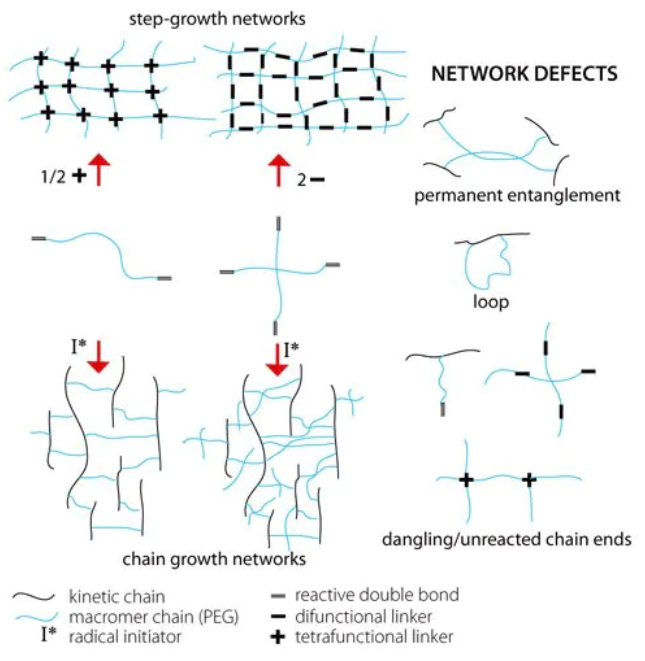
图3:不同形成机理导致的对水凝胶网络结构和网络缺陷的影响
水凝胶的降解
为了使用3D水凝胶支架来研究细胞分化和组织进化,通过空间和时间调控的方式来设计凝胶的物理和化学性质是至关重要的[10]。聚合物材料性质通常借由聚合/交联(键形成)或借由受控降解及/或释放(键断裂)来改变。键的形成通常会用到小分子试剂(引发剂、催化剂,单体、连接到材料的配体),而键断裂则通常不依赖于外源试剂。小分子在体外和体内均具有比聚合物试剂更多的副反应,因此许多研究小组用降解作为原位操作聚合物生物材料的工具。
水解降解
水凝胶中最常用的降解机理就是水解,即一个水分子加入到聚合物骨架中,导致链断裂。酸酐、酯和酰胺都很容易水解,任何氢化物通常水解得太快,而酰胺类的若未经过催化则水解太慢,因此大多数水凝胶的水解降解都是利用酯键。为了获得具有生理相关时间维度上的可降解水凝胶,研究人员通常使用交酯或乙醛交酯段将具有可降解酯键的PEG功能化。
PEG上的醇链末端可引发3,6-二甲基-1,4-二恶烷-2,5-二酮和1,4-二恶烷-2,5-二酮的开环反应,分别生成聚乙二醇交酯和聚乙二醇交酯(图4)[11]。开环反应通常由锡(II)-2-乙基己酸盐催化[12],但使用二甲氨基吡啶作为催化剂也很容易完成反应[13],二甲氨基吡啶可能比残余锡更容易除去。聚乙二醇交酯或聚乙二醇交酯的醇链末端很容易被丙烯酸酯和甲基丙烯酸酯等反应性双键官能化。
图4:聚乙二醇乙交酯和聚乙二醇丙交酯的合成
酶促降解
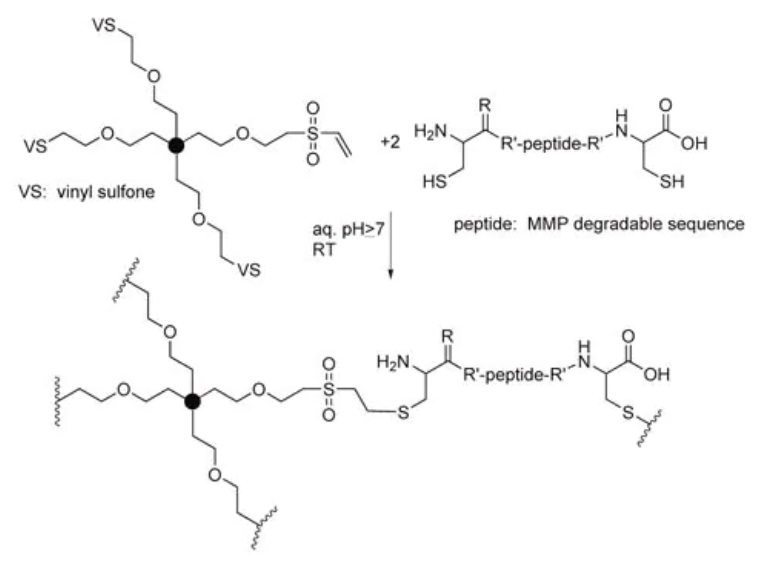
虽然酯键是可通过酶降解的,但大多数研究人员都会使用具有特异性序列的酶降解掺入水凝胶中的肽,而不是非特异性的酶降解酯和酰胺。Hubbell团队率先使用了这一方法[14],他们通过Michael加成反应把丙烯酸酯、马来酰亚胺和乙烯基砜官能化的半胱氨酸肽,将基质金属蛋白酶(MMP)具有反应敏感型的连接键引入水凝胶(图5)[15]。
MMP-可降解键也被用作联结治疗剂与水凝胶的载体。例如,血管内皮生长因子(VEG-F)等生长因子可通过酶降解MMP-敏感性链而释放,从而诱导血管生成[16]。
在水解和酶解过程中,降解速率由大分子的化学性质决定。在水解中,材料的降解率是通过其本身的性质(如疏水性或亲水性)和可水解基团的数量预先设计的,并且一旦材料被制造出来,就不能改变。在酶解过程中,降解通常发生在产生酶的细胞局部区域。水解和酶解均是水凝胶缓释和缓释治疗药物的有效方法,但水凝胶制备后无法调节或阻滞其释放速率,且释放不受空间限制。
光降解型水凝胶
与水解和酶降解相比,光降解允许更加精准的空间和时间控制降解和释放。虽然已有许多研究者报道了光聚合水凝胶和光功能化水凝胶,但关于生物相容性光降解水凝胶的报道很少。Kloxin和Kasko发表了由含2-甲氧基-5-硝基-4-(1-羟乙基)苯氧丁酸的PEG高分子形成的光可降解水凝胶网络(图6)[17];邻-硝基苄基(o-NB)连接基团的光降解行为具有良好的表现。由光降解聚合物形成的水凝胶在光照下表现出体积降解,这与曝光时间、波长和光强度有关。当光线被关闭时,降解停止;在恢复光暴露后,上述样品继续光解。hMSCs(人骨髓间充质干细胞)被包裹在含有光可释放的细胞黏附配体RGDS(精氨酸-甘氨酸-天冬氨酸-丝氨酸)的水凝胶中,当RGD在第10天释放时(与纤维连接蛋白在软骨形成过程中的下调相对应),hMSCs沿成软骨途径分化。这种可降解水凝胶的表面侵蚀和透胶光刻可用于形成从10-7-10-2米或更大范围的特征局部区域[18]。部分降解导致水凝胶的交联密度降低和溶胀程度增加,这提供了一种如何制备柔软性更高的水凝胶的方法。
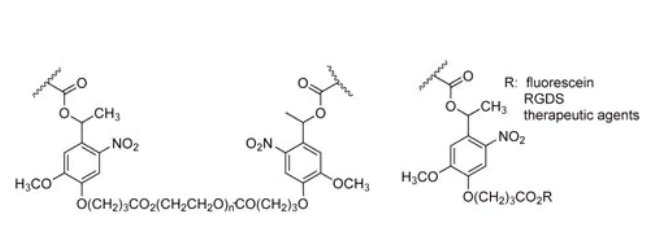
图6:光降解o-NB掺杂的水凝胶骨架用于释放治疗药剂
除了单光子光解,含有o-NB的水凝胶也对双光子光解敏感,从而允许被用于3D蚀刻[19-20]。在单光子反应中,任何暴露在光下的区域都会发生反应。相反,多光子光刻应该只发生在多个光子同时被吸收的地方,这发生在光源的焦体积(如图7)。生物材料的单光子光刻的典型波长范围从长波UV(≥365 nm)到可见光区域,而双光子光刻则使用红外光(通常~ 740-800 nm)较多。红外光具有更好的生物相容性,对活体组织的破坏性更小,并能够有更大的穿透深度。发生双光子吸收的区域也被严格限制在了光的焦点上,而不是沿着光的整个路径,提供了对激发3D控制的新思路。单光子和多光子反应都有能力制备出特征点小于500 nm的材料,远小于哺乳动物细胞的大小[21]。这代表了对水凝胶支架结构和化学的空间控制水平达到了前所未有的高度。
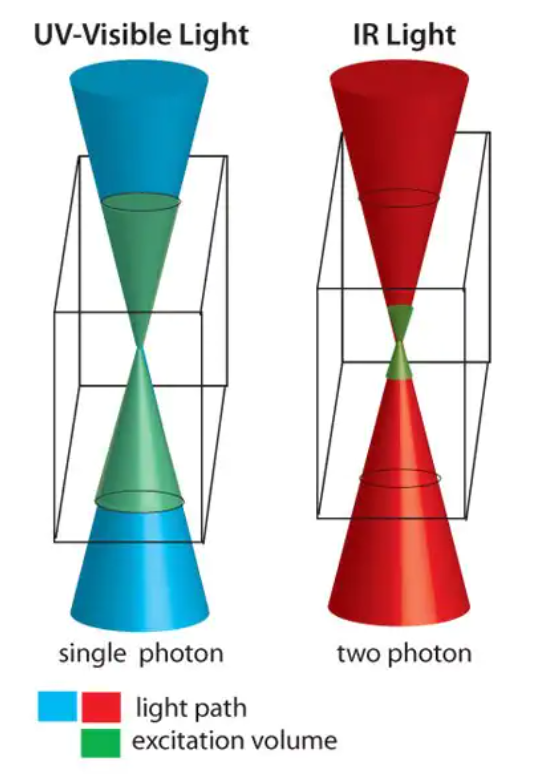
图7:单光子光解(左)发生在暴露于紫外-可见光的水凝胶的整个区域
双光子光解(右)只发生在同时吸收两个红外光光子的区域o-NB连接子还可用于将治疗剂拴系到水凝胶中以实现在活细胞中的递送。Griffin等证明了通过o-NB-PEG高分子栓系到水凝胶中可以实现荧光素的受控释放[22]。在不同波长(365-436 nm)、不同强度(5-20 mW/cm2)和不同时间(0-20分钟)的光照射下,对模型的释放进行定量分析。虽然最快的释放发生在365 nm(这对应于在该波长的o-NB连接剂的较高摩尔吸收率),显著的释放也同样见于405 nm;从分子的物理常数(如摩尔吸收率)上去推测很容易模拟释放。在这些体系中,光的衰减使化学和机械梯度容易形成。
小结
聚乙二醇是一种易制备、易改性的聚合物。它被广泛应用于水凝胶制造,包括作为组织培养的2D和3D支架。聚乙二醇水凝胶易于引入可降解键。水解可降解凝胶允许持续的材料降解和/或治疗剂释放。酶降解凝胶的降解和释放是由细胞决定的。光降解允许用户对水凝胶的化学和物理性质进行实时定制的外部操作。参考文献
1. Drury JL, Mooney DJ. 2003. Hydrogels for tissue engineering: scaffold design variables and applications. Biomaterials. 24(24):4337-4351. http://dx.doi.org/10.1016/s0142-9612(03)00340-5
2. Lee KY, Mooney DJ. 2001. Hydrogels for Tissue Engineering. Chem. Rev.. 101(7):1869-1880. http://dx.doi.org/10.1021/cr000108x
3. HOFFMAN AS. Hydrogels for Biomedical Applications. 944(1):62-73. http://dx.doi.org/10.1111/j.1749-6632.2001.tb03823.x
4. Hoffman AS. 2002. Hydrogels for biomedical applications. Advanced Drug Delivery Reviews. 54(1):3-12. http://dx.doi.org/10.1016/s0169-409x(01)00239-3
5. Tibbitt MW, Anseth KS. 2009. Hydrogels as extracellular matrix mimics for 3D cell culture. Biotechnol. Bioeng.. 103(4):655-663. http://dx.doi.org/10.1002/bit.22361
6. Lin C, Anseth KS. 2009. PEG Hydrogels for the Controlled Release of Biomolecules in Regenerative Medicine. Pharm Res. 26(3):631-643. http://dx.doi.org/10.1007/s11095-008-9801-2
7. Richter A, Paschew G, Klatt S, Lienig J, Arndt K, Adler H. Review on Hydrogel-based pH Sensors and Microsensors. Sensors. 8(1):561-581. http://dx.doi.org/10.3390/s8010561
8. Ruel-Gariépy E, Leroux J. 2004. In situ-forming hydrogels?review of temperature-sensitive systems. European Journal of Pharmaceutics and Biopharmaceutics. 58(2):409-426. http://dx.doi.org/10.1016/j.ejpb.2004.03.019
9. Yang Z, Xu B. 2007. Supramolecular hydrogels based on biofunctional nanofibers of self-assembled small molecules. J. Mater. Chem.. 17(23):2385. http://dx.doi.org/10.1039/b702493b
10. Zalipsky S, Harris JM. 1997. Introduction to Chemistry and Biological Applications of Poly(ethylene glycol).1-13. http://dx.doi.org/10.1021/bk-1997-0680.ch001
11. Davis FF. 2002. The origin of pegnology. Advanced Drug Delivery Reviews. 54(4):457-458. http://dx.doi.org/10.1016/s0169-409x(02)00021-2
12. Morpurgo M, Veronese FM, Kachensky D, Harris JM. 1996. Preparation and Characterization of Poly(ethylene glycol) Vinyl Sulfone. Bioconjugate Chem.. 7(3):363-368. http://dx.doi.org/10.1021/bc9600224
13. Lutolf MP, Hubbell JA. 2005. Synthetic biomaterials as instructive extracellular microenvironments for morphogenesis in tissue engineering. Nat Biotechnol. 23(1):47-55. http://dx.doi.org/10.1038/nbt1055
14. Sawhney AS, Pathak CP, Hubbell JA. 1993. Bioerodible hydrogels based on photopolymerized poly(ethylene glycol)-co-poly(.alpha.-hydroxy acid) diacrylate macromers. Macromolecules. 26(4):581-587. http://dx.doi.org/10.1021/ma00056a005
15. Du YJ, Lemstra PJ, Nijenhuis AJ, Van Aert HAM, Bastiaansen C. 1995. ABA Type Copolymers of Lactide with Poly(ethylene glycol). Kinetic, Mechanistic, and Model Studies. Macromolecules. 28(7):2124-2132. http://dx.doi.org/10.1021/ma00111a004
16. Kim H, Kim HW, Suh H. 2003. Sustained release of ascorbate-2-phosphate and dexamethasone from porous PLGA scaffolds for bone tissue engineering using mesenchymal stem cells. Biomaterials. 24(25):4671-4679. http://dx.doi.org/10.1016/s0142-9612(03)00358-2
17. Benoit DS, Nuttelman CR, Collins SD, Anseth KS. 2006. Synthesis and characterization of a fluvastatin-releasing hydrogel delivery system to modulate hMSC differentiation and function for bone regeneration. Biomaterials. 27(36):6102-6110. http://dx.doi.org/10.1016/j.biomaterials.2006.06.031
18. West JL, Hubbell JA. 1999. Polymeric Biomaterials with Degradation Sites for Proteases Involved in Cell Migration. Macromolecules. 32(1):241-244. http://dx.doi.org/10.1021/ma981296k
19. Lutolf MP, Hubbell JA. 2003. Synthesis and Physicochemical Characterization of End-Linked Poly(ethylene glycol)-co-peptide Hydrogels Formed by Michael-Type Addition. Biomacromolecules. 4(3):713-722. http://dx.doi.org/10.1021/bm025744e
20. Lutolf MP, Lauer-Fields JL, Schmoekel HG, Metters AT, Weber FE, Fields GB, Hubbell JA. 2003. Synthetic matrix metalloproteinase-sensitive hydrogels for the conduction of tissue regeneration: Engineering cell-invasion characteristics. Proceedings of the National Academy of Sciences. 100(9):5413-5418. http://dx.doi.org/10.1073/pnas.0737381100
21. Zisch AH, Lutolf MP, Ehrbar M, Raeber GP, Rizzi SC, Davies N, Schm?kel H, Bezuidenhout D, Djonov V, Zilla P, et al. 2003. Cell-demanded release of VEGF from synthetic, biointeractive cell-ingrowth matrices for vascularized tissue growth. FASEB j.. 17(15):2260-2262. http://dx.doi.org/10.1096/fj.02-1041fje
22. Kloxin AM, Kasko AM, Salinas CN, Anseth KS. 2009. Photodegradable Hydrogels for Dynamic Tuning of Physical and Chemical Properties. Science. 324(5923):59-63. http://dx.doi.org/10.1126/science.1169494