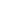核酸电泳工作流程-5大主要步骤
发表时间:2022-11-22凝胶电泳是许多分子生物学实验的重要部分。建立核酸电泳需采取一系列步骤来实现核酸样品的最佳分离和分析。核酸凝胶电泳工作流程中的关键步骤包括:
1.选择和制备凝胶
a.琼脂糖凝胶 b.聚丙烯酰胺凝胶 c.凝胶制备中的缓冲液选择
2.准备标准品和样品
a.核酸梯度选择 b.样品和梯度准备 c.加载染料和缓冲液选择
3.运行电泳
a.电泳缓冲选择 b.电压 c.电泳时间
4.在凝胶中可视化样品
a.荧光染色 b.紫外阴影
5.记录凝胶
a.荧光成像 b.射线自显迹法
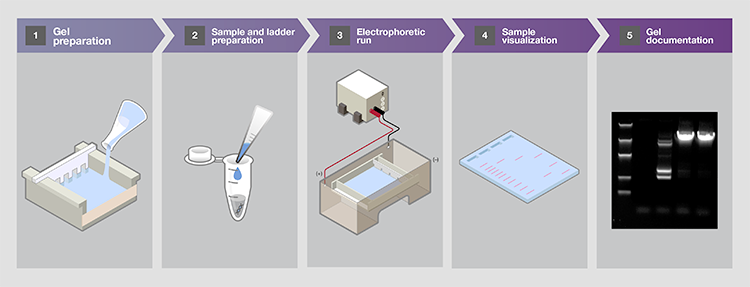
图1.核酸凝胶电泳的5大关键步骤。
1.选择和制备凝胶
琼脂糖(9012-36-6)和聚丙烯酰胺(9003-05-8)是核酸分离中最常用的两种凝胶基质。两种材料都是三维基质,孔径大小适合核酸分离,且与样品间无反应。可通过改变基质的百分比来调整孔径大小,从而有效分离不同大小的核酸。
有关琼脂糖凝胶和聚丙烯酰胺之间的选择,主要取决于核酸样品的大小和所希望达到的分辨率,虽然凝胶灌制和样品回收的方法也可考虑(表1)。琼脂糖凝胶的孔径大小非常理想,可分离0.1-25 kb范围内的核酸分子。聚丙烯酰胺形成的孔径较小,可用于分离小于1 kb的核酸分子。某些情况下,可采用聚丙烯酰胺凝胶以获得片段小于100bp的单碱基分辨率[1]。
表1.琼脂糖凝胶和聚丙烯酰胺凝胶之间的差异
|
|
琼脂糖 |
聚丙烯酰胺 |
|
来源 |
来源于海藻的多糖聚合物 |
丙烯酰胺交联,甲叉双丙烯酰胺 |
|
凝胶灌制方法 |
融化和凝固 |
开始化学反应 |
|
核酸回收 |
融化和凝固 |
溶解和扩散,或电解 |
|
DNA分离范围 |
50-50,000 bp |
5-3,000 bp |
|
分辨力 |
5-10核苷酸 |
单核苷酸 |
a.琼脂糖凝胶
关于凝胶制备,琼脂糖凝胶通常以粉末形式提供,近年来也有方便的预称重片可供使用。为简化工作流程、节省时间,可考虑预制琼脂糖凝胶,其在某些 市售系统中作为集成单元来运行、可视化和分析。
制备您自己的琼脂糖凝胶,凝胶比例计算为:
凝胶%(w/v)=(琼脂糖g/缓冲液ml)x 100%
凝胶灌制时,如果使用了荧光核酸染色剂(溴化乙锭1239-45-8),可在凝胶灌制时加入推荐浓度(例如,溴化乙锭0.5 μg/mL)。
表2为不同长度的DNA片段分离提供了推荐的琼脂糖凝胶百分比[2]。一般而言,较高比例的凝胶便于更小片段、更好的分离和分辨(图2)。注意,低比例凝胶十分脆弱且难以操作,而高比例凝胶则较浑浊,且会干扰可视化。
表2.推荐百分比琼脂糖凝胶用于DNA片段分离。
|
凝胶百分比 |
高效分离的范围(bp) |
|
0.5 |
2,000–50,000 |
|
0.6 |
1,000–20,000 |
|
0.7 |
800–12,000 |
|
0.8 |
800–10,000 |
|
0.9 |
600–10,000 |
|
1.0 |
400–8,000 |
|
1.2 |
300–7,000 |
|
1.5 |
200–3,000 |
|
2.0 |
100–2,000 |
|
3.0 |
25–1,000 |
|
4.0 |
10–500 |
|
5.0 |
10–300 |
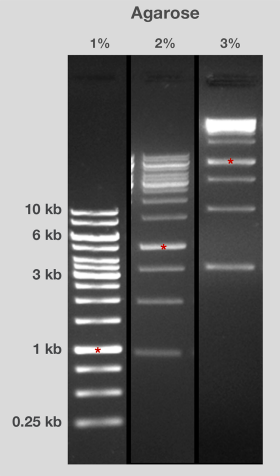
图2.不同百分比的琼脂糖凝胶中DNA片段的流动性。在相同条件下(包括运行时间),在1%、2%和3%琼脂糖凝胶上分离出相同的DNA阶梯。1kb片段用红色星号表示,以供比较。
琼脂糖成分
琼脂糖是一种经过纯化的琼脂,是海洋红藻细胞壁的碳水化合物结构组成部分。 琼脂糖是一种分子量约为12万的无支链(线性)聚合物,含有800-1000个单糖。 琼脂糖链由一种重复的异二糖-即-D-半乳糖和3,6-酐-α-L-半乳糖通过1-4糖苷键结合而成。 双糖单位,也称琼脂二糖,通过a-1、3连接形成了一个链(图3)。
图3.琼脂糖的结构单元。琼脂糖由400-500个琼脂二糖单位组成。
琼脂糖溶液加热并冷却后,就会形成凝胶基质。其孔洞直径从50到200纳米不等,由凝胶浓度控制。温度高于90℃,琼脂糖便会融化,变成无规卷曲。冷却后,两个琼脂糖链形成由氢键连接的螺旋纤维。进一步冷却至胶凝固点以下(通常小于40°C),则会有更多氢键连接形成螺旋束网络,进而形成具有三维网格的凝胶(图4)[3,4]。 由于氢键,琼脂糖形成的凝胶加热可逆。因此,通过溶解含有目的片段的凝胶,可提取电泳分离出的核酸。
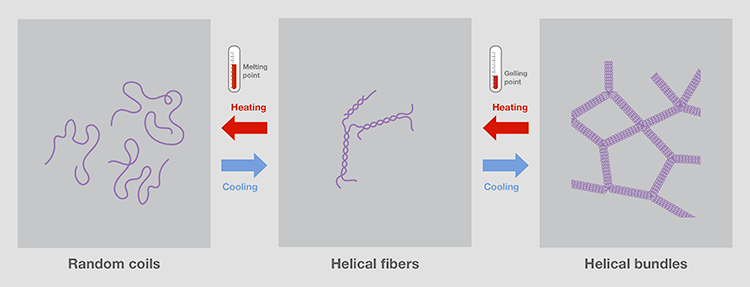
图4.通过加热和冷却改变溶液中琼脂糖的结构。
对大于10kbp DNA的提取,低熔点(LMP)的琼脂糖是较合适的选择。LMP琼脂糖在65度左右(1%的凝胶)融化—相对较低的温度,确保可以温和地提取凝胶中完整的核酸大分子。 LMP琼脂糖的低凝胶温度(~25°C)使其成为凝胶内酶反应的理想选择(例如,连接)。酶在半固态的琼脂溶液中处于活跃状态。
b.聚丙烯酰胺凝胶
聚丙烯酰胺-丙烯酰胺和交联剂—双丙烯酰胺(简称为“bis”)的组分-可以粉末形式提供,但为了方便通常预先制备成原液。该粉末和液体形式是为大家所知的神经毒素,应使用实验室防护性设施,小心操作。在凝胶中,丙烯酰胺和双丙烯酰胺(以%T表示)的总浓度决定了孔隙大小—通常直径为20-150纳米。百分比越高,孔隙越小,可分辨的分子也更小。表3展示了常用的凝胶比例[2]。
表3.用于分离核酸片段的聚丙烯酰胺凝胶的推荐百分比。变性凝胶用于分离线性单链核酸(尺寸由碱基表示),而非变性凝胶主要用于双链核酸(bp=碱基对)。
|
聚丙烯酰胺凝胶(bis,19:1) |
有效分离的范围 |
|
变性凝胶 |
|
|
4.0 |
100-500 bp |
|
5.0 |
70-400 bp |
|
6.0 |
40-300 bp |
|
8.0 |
30-200 bp |
|
10.0 |
20-100 bp |
|
15.0 |
10-50 bp |
|
20.0 |
5-30 bp |
|
30.0 |
1-10 bp |
|
非变性凝胶 |
|
|
3.5 |
100-1,000 bp |
|
5.0 |
80-500 bp |
|
8.0 |
60-400 bp |
|
12.0 |
50-200 bp |
|
15.0 |
25-150 bp |
|
20.0 |
5-100 bp |
核酸分离,通常采用3–30%(%T)的聚丙烯酰胺凝胶。除%T之外,双丙烯酰胺(交联剂)与总丙烯酰胺(%C)的重量百分比是聚丙烯酰胺凝胶孔隙大小和样品分离的的关键(表4)。
%T和%C可以表示为:
%T(w/v)=[(丙烯酰胺+双丙烯酰胺)g/缓冲液ml]x 100%
%C(w/w)=[双丙烯酰胺g/(丙烯酰胺+双丙烯酰胺)g]x 100%
表4.聚丙烯酰胺凝胶的常见组分[5]
|
丙烯酰胺:bis |
%C |
相对孔隙大小 |
研究应用 |
|
19:1 |
5% |
小 |
DNA和变性凝胶 |
|
29:1 |
3.3% |
中 |
非变性凝胶中ssDNA和RNA |
|
37.5:1 |
2.7% |
大型 |
蛋白凝胶 |
聚丙烯酰胺的基本原理
聚丙烯酰胺是由丙烯酰胺单体聚合而成的聚合物,通常与双丙烯酰胺或N,N'-亚甲基双丙烯酰胺结合使用。交联剂双丙烯酰胺含有两个单位通过亚甲基桥连的丙烯酰胺。聚合是被TEMED 催化(N,N,N′,N′-四甲基乙二胺)的自由基反应-通常由过硫酸铵(APS)引发(图 5)。因此,在既定温度下,APS和/或TEMED的浓度决定了聚合速率。
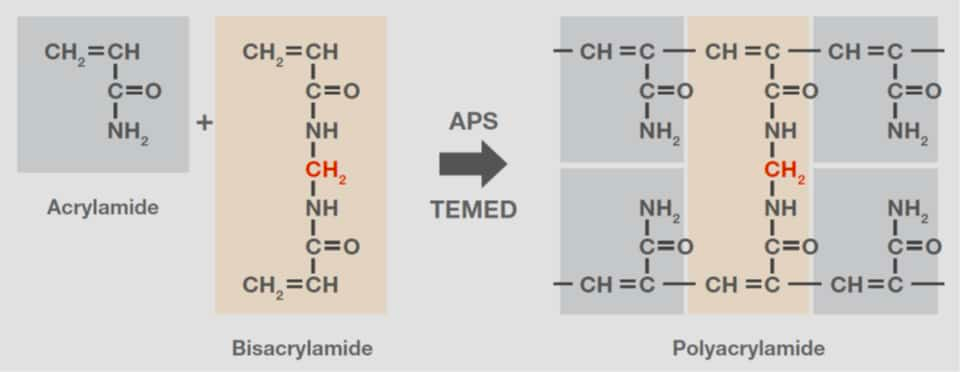
图5.丙烯酰胺形成聚丙烯酰胺,双丙烯酰胺结构展示。双丙烯酰胺含有两个单位通过亚甲基桥连的丙烯酰胺(红色)。
c.凝胶制备中的缓冲液选择
使用具有导电性的离子溶液制备琼脂糖和聚丙烯酰胺凝胶,确保核酸在电泳过程中具有迁移性。电泳过程中,凝胶和电泳缓冲液通常使用相同类型的缓冲液,以保持相同的pH值和离子强度。核酸电泳常用的两种缓冲液为Tris-醋酸盐EDTA (TAE)和Tris-硼酸盐EDTA (TBE),两者都有接近中性的pH值,有利于带负电荷的核酸。
为分析单链DNA或RNA,琼脂糖和聚丙烯酰胺凝胶通常在变性条件下制备和运行。变性条件会破坏核酸之间形成的氢键,从而减少像发夹环这样二级结构的形成。因此对RNA分离和分析而言,变性电泳更常用。琼脂糖和聚丙烯酰胺凝胶核酸电泳中常用的变性缓冲液包括:
-
琼脂糖:磷酸钠缓冲液中的乙二醛和DMSO、NaOH-EDTA缓冲液、MOPS缓冲液中的甲醛或甲酰胺等
-
聚丙烯酰胺: TBE缓冲液中的尿素
2.准备标准品和样品
a.核酸标准品选择
当运行凝胶时,含有已知大小的核酸参照样品通常被称为标准品、标记或 分子量标准,用于目的样品大小的估计。 在为给定样品选择合适的分子量标准时,需考虑如下因素:
-
Ladde类型(例如DNA或RNA),片段结构(例如单链或双链),构象(例如超螺旋、开环或线性)以确保对迁移进行适当比较
-
片段的数量和适当的分离形式,用于大小的估计
-
预期用途,如分子量标准是设计用于定性分析还是精确的定量测定
-
不同类型凝胶适用的分子量标准(例如,部分预制凝胶推荐设计 特定分子量标准以获得最佳运行结果)
-
上样染料的性质,避免目的条带模糊(图6)
-
上样缓冲液与使用凝胶的兼容性(例如,缓冲液的盐浓度会影响样品的迁移)
早期,DNA的大小标准主要来源于病毒基因组片段((例如,λφX174)和细菌质粒(如pUC19)的限制内切。该标准物在内切、样品纯度和电泳中带型的重现性方面存在问题。而后,从连接反应和/或PCR中获取的含有片段的分子量标准,因具有再现性且可产生预期大小的片段,而备受青睐。如今,因为色谱纯化片段实现了质量、带型、强度和数量等方面的更高控制,被视为分子量标准黄金标准(图6)。
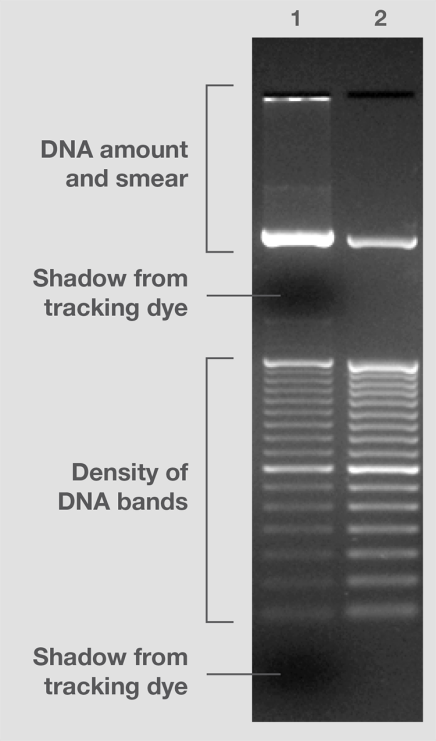
图6.DNA 分子量标准差异。 分子量标准 #2由色谱纯化的DNA片段组成,存在于上佳的上样缓冲液中,可产生相等或预期强度的条带,并且不含有条带污点,无染色阴影。 与此相反,分子量标准 #1采用较老技术制造,并存在于次优组分的缓冲液中。
此外,还设计出室温下稳定、适合运输和储存,以及方便和少环境影响的分子量标准。而预混合,即用型分子量标准也可供选择—添加了最佳浓度、可直接上样到凝胶的上样染料的分子量标准。
注意,由不同制造商生产、描述相同(例如,1kb或100bp)的分子量标准,包含DNA片段的数量、大小和密度可能会有所不同(图7)。使用前,请参考制造商提供的指南和协议,获取分子量标准组成及其使用用途准确而详细的说明。
与DNA分子量标准不同,RNA分子量标准通常与含有变性剂的上样缓冲液一同提供。变性剂可维持RNA的单链形式,确保样品可预测的迁移和分离结果。当运行RNA凝胶电泳时,应避免使用DNA分子量标准,因为双链分离,在变性条件下使用会导致非规则方式分离。

图7.两个不同供应商A和B,提供具有相同描述的DNA分子量标准片段组成差异。
b.样品和标准品准备
须计算上样到凝胶中的DNA量,以确保目的条带良好分离,并用于可视化和检测。虽然用荧光染料足以检测1-100ng/条带的DNA,但最小可检测量取决于所用染料[6]。注意,样品或标准品的超载会造成条带污点并遮盖附近条带,从而导致条带分辨不清,特别是片段大小相似时(图8A)。

图8.次优样品分离。 (A) 负载影响条带分辨率。 (B) 上样量过低会导致条带扭曲。
在上样缓冲液中准备好样品和分子量标准,其最终的体积通常占胶孔体积的30%。 由于孔底分布不均匀(图8B),使用较少的上样体积会导致条带扭曲。对于含有DNA结合蛋白或粘性末端的样品,凝胶上样之前,混合物需加入至含有SDS的上样染料中一同加热,因为蛋白质结合以及DNA片段之间的相互作用会导致分离效果不佳(图10B)。
c .上样染料和缓冲液选择
制备凝胶电泳时,样品中添加了凝胶上样缓冲液 (通常是6X或10X的原液)。 上样缓冲液包括如下组分:
-
密度成分,如甘油或蔗糖,增加样品粘度,确保样品沉入孔中。
-
盐,如Tris-HCl,为样品创造良好的离子强度和pH值环境。 高盐浓度的上样缓冲液会产生更大片或扭曲的条带以及污点。
-
金属螯合剂,如EDTA,可阻止样品中的核酸酶降解核酸。
-
染料 为监测样品的上样、电泳进展和pH值变化提供了颜色指示。 部分上样缓冲液可能包含多个染料,以便有效跟踪样品中不同大小分子的迁移。
通常,上样染料都是带负电荷的小分子,因此迁移方向与核酸相同。 其中有的显示pH值颜色,上样和运行时可作为样品的pH指示剂(图9A)。 常用染料包括溴酚蓝、二甲苯青,苯酚红,和橙色G。选择上样缓冲液时,需注意染料的表面迁移(s)(图9B, 表5和6)以避免遮盖目的核酸条带,特别是分子大小接近时(图9C)。 染料遮盖会影响目的条带的分析和量化,导致结果不可靠。
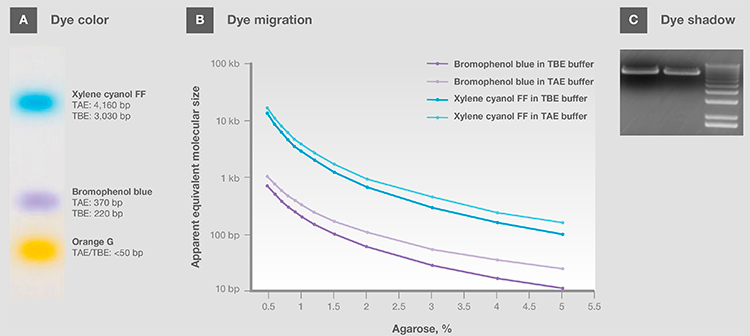
图9.(A)中性pH中染料颜色。(B)在TAE和TBE缓冲液中不同百分比琼脂糖里的染料迁移。(C)在可视化过程中染料阴影遮盖条带。
有时,上样缓冲液包含清洗剂或还原剂,如SDS, 尿素和甲酰胺,以用于变性。此类添加剂可破坏核酸分子内部和分子间的相互作用,促成线性或单链的分子构象。为获得最佳分离结果,应将样品和变性剂加入至上样染料中一同加热(图 10A)。对来源于酶反应的双链DNA电泳,可将SDS添加到上样缓冲液,以破坏蛋白质和核酸之间的相互作用,防止样品迁移性改变(图10B)。
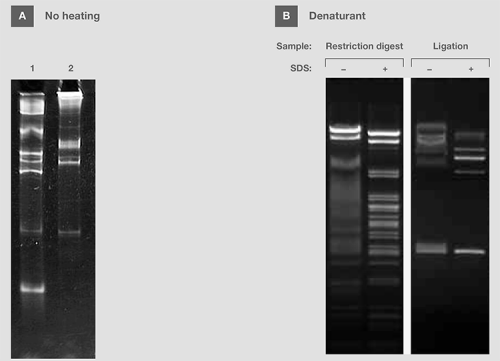
图10,热量、SDS对样品电泳的影响。(A) 在不加热处理的情况下,将含有RNA分子量标准的变性缓冲液加入凝胶中。 (B) 在有或无SDS的上样缓冲液中准备来源于限制性内切和连接反应的DNA样品。 在凝胶上样前,加热SDS中的样品。
表5.琼脂糖和聚丙烯酰胺凝胶中,溴酚蓝和二甲苯青FF的表观分子大小[2]。
(A)TBE和TAE缓冲液中的琼脂糖凝胶
|
|
溴酚蓝 |
二甲苯青FF |
||
|
凝胶% |
TBE |
TAE |
TBE |
TAE |
|
0.5 |
750 bp |
1,150 bp |
13,000 bp |
16,700 bp |
|
0.6 |
540 bp |
850 bp |
8,820 bp |
11,600 bp |
|
0.7 |
410 bp |
660 bp |
6,400 bp |
8,500 bp |
|
0.8 |
320 bp |
530 bp |
4,830 bp |
6,500 bp |
|
0.9 |
260 bp |
440 bp |
3,770 bp |
5,140 bp |
|
1.0 |
220 bp |
370 bp |
3,030 bp |
4,160 bp |
|
1.2 |
160 bp |
275 bp |
2,070 bp |
2,890 bp |
|
1.5 |
110 bp |
190 bp |
1,300 bp |
1,840 bp |
|
2.0 |
65 bp |
120 bp |
710 bp |
1,040 bp |
|
3.0 |
30 bp |
60 bp |
300 bp |
460 bp |
|
4.0 |
18 bp |
40 bp |
170 bp |
260 bp |
|
5.0 |
12 bp |
27 bp |
105 bp |
165 bp |
(B)变性和非变性缓冲液中的聚丙烯酰胺凝胶
|
酰胺: bis (19:1), 胶凝% |
溴酚蓝 |
二甲苯青FF |
|
变性凝胶 |
||
|
4.0 |
50碱基 |
230碱基 |
|
5.0 |
35碱基 |
130碱基 |
|
6.0 |
26碱基 |
105碱基 |
|
8.0 |
19碱基 |
75碱基 |
|
10.0 |
12碱基 |
55碱基 |
|
15.0 |
10碱基 |
40碱基 |
|
20.0 |
8碱基 |
28碱基 |
|
30.0 |
6碱基 |
20碱基 |
|
非变性凝胶 |
||
|
3.5 |
100 bp |
460 bp |
|
5.0 |
65 bp |
260 bp |
|
8.0 |
45 bp |
160 bp |
|
12.0 |
20 bp |
70 bp |
|
15.0 |
15 bp |
60 bp |
|
20.0 |
12 bp |
45 bp |
3.运行电泳
在凝胶、标准品和样品制备后,进行电泳。拆卸梳子和添加电泳缓冲液前,凝胶须完全凝固。凝胶梳应平稳地向上提起,以免撕裂凝胶、扭曲胶孔。移除梳子和添加缓冲液后,注意清除孔里的气泡。对于聚丙烯酰胺凝胶,应用缓冲液彻底冲洗胶孔,以清除残留未聚合的丙烯酰胺。
水平凝胶应朝向凝胶盒,样品孔位于负极一侧,以便在电泳启动后,将样品移动至正电极侧(图11A)。该方向可记为“跑向红色”,因为正电极通常为红色。 垂直凝胶盒中,胶孔设计在顶部(图11B)。
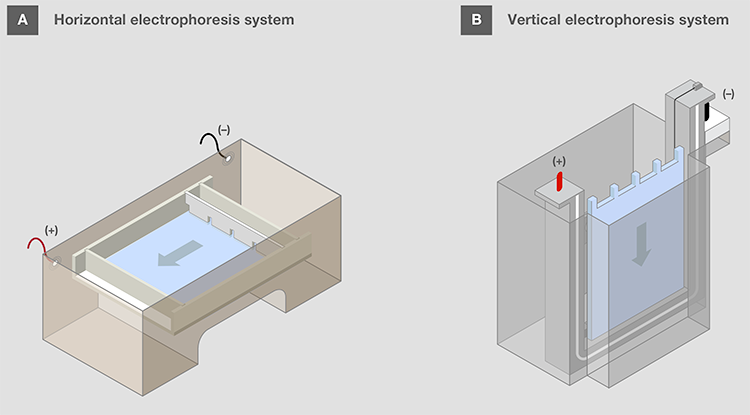
图11.水平和垂直电泳系统的凝胶装置。 箭头表示电泳中核酸迁移的方向。
a.电泳缓冲液选择
电泳缓冲液为具有缓冲能力的离子溶液,通常在凝胶中使用,以保证电流流动同时防止pH值变化。电泳过程中,由于电子流动,负极逐渐偏向碱性,正极逐渐偏向酸性,从而导致水电解和pH值改变(表6)。氢气和氧气的释放会引起电极起泡,这是凝胶运行的迹象。理想情况下,电泳缓冲液和凝胶制备缓冲液应相同,以确保有效的导电性。
表6.两个电极的化学反应和pH值变化。
|
电极 |
负极(-) |
正极(+) |
|
电子流 |
In |
出 |
|
化学反应 |
4 H2O + 4 e– → 2 H2 (gas) + 4 OH– |
2 H2O → O2 (gas) + 4 H+ + 4 e– |
|
pH变化 |
基本 |
酸性 |
电泳缓冲液的选择取决于样品大小、运行时间和后电泳过程,其中Tris-醋酸盐EDTA(TAE)和Tris-硼酸 EDTA(TBE)是最常用的两种缓冲液(表 7)[2,7]。
-
因为不容易形成污点,TAE适用于>1500bp的片段。由于缓冲能力较低,TAE更适合短时间的电泳运行(例如<2小时)。TAE缓冲能力较低,长时间运行凝胶会导致过热,样品变性和/或扩散以及凝胶融化(可能)。
-
TBE缓冲能力较高,不易导致过热,因此更适合长时间运行。对于较短片段的分离,TBE效果更佳,而在TBE中,dsDNA迁移得更慢。TBE可抑制酶,因此不适合涉及酶学步骤的下游应用,如限制内切、克隆和PCR。
使用离子强度高于1X TAE或0.5-1X TBE缓冲液,可更快地移动样品,但由于高导电性会产生大量的热量,容易导致样品变性和凝胶损伤。
表7.缓冲液选择指南。
|
缓冲液 |
产品优势 |
缺点 |
核酸分辨率 |
|
|
DNA |
RNA |
|||
|
TAE |
|
更容易导致过热
|
>1,000 bp |
>1,500 bp |
|
TBE |
|
抑制酶,不适合下游酶学步骤(如克隆) |
<5,000 bp |
<1,500 bp |
凝胶应完全浸在缓冲液中,以确保离子流动,防止凝胶干(图12A)。然而,当使用水平凝胶时(例如,琼脂糖),凝胶上的缓冲液深度应低于3–5mm。缓冲液过高(>5 mm)会导致核酸迁移性降低,加大条带扭曲和过热。
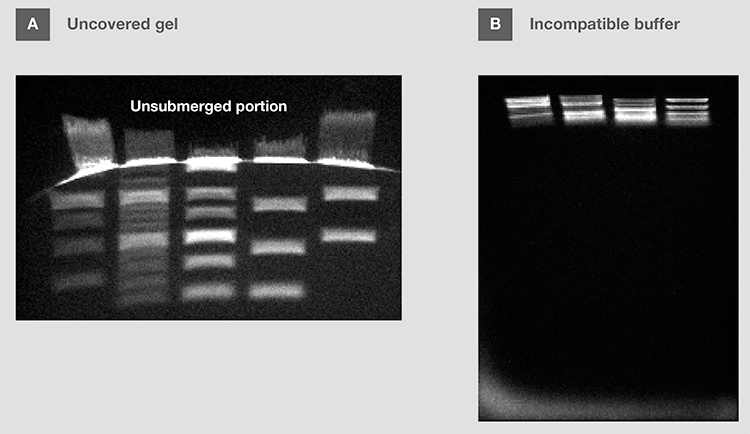
图12.电泳缓冲液对电泳的影响。(A) 在电泳过程中,凝胶的顶部部分未被浸没。(B) 在低于推荐浓度的盐浓度缓冲液中运行凝胶(与凝胶制备中使用的缓冲液不同)。
注意,变性琼脂糖的电泳缓冲液可能既不是TAE,也不是TBE,因为这些凝胶可能在不同的缓冲液中制备,如磷酸钠和MOPS。选择与所用凝胶兼容的电泳缓冲液非常重要(图12B)。
b.电压
采用恒定电压、电流或功率通过凝胶,施加电势,开始运行凝胶。核酸电泳中常用恒压,一般为5–10 V/cm。
施加的电压(V)=电极间的距离(cm)x建议V/cm
可根据需要分离的DNA片段的大小调整电压,也可以根据所使用的电泳缓冲液的类型进行调整(表 8)。市售核酸分子量标准通常提供建议电压,以便每个产品片段实现最佳分离。注意,电压极低会减缓核酸的迁移,从而导致小分子的扩散和分辨率过低(图13A)。另一方面,电压过高,会导致较差的分离效果和样品污点;有时,还会造成缓冲液过热,“微笑型条带”,甚至是样品变性(图13B)。
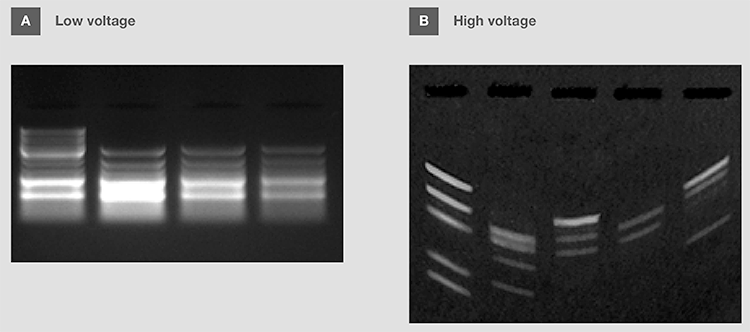
图13. 电压对DNA电泳的影响。 (A)低电压导致条带分辨率差和扩散。 (B)高电压导致“微笑型条带”。
表8. 基于片段大小的运行条件[2]。
|
DNA大小 |
电压 |
最佳电泳缓冲液 |
|
<1 kb |
5-10 V/cm |
TBE |
|
1-5 kb |
4-10 V/cm |
TAE 或 TBE |
|
>5kb |
1-3 V/cm |
TAE |
|
最长 10 kb |
最高 23 V/cm |
TAE |
某些情况下,可将温度探头连接至凝胶装置,以帮助控制缓冲液的冷却和加热。 电泳运行>2小时,缓冲液的冷却和再循环可改善样品分离。变性凝胶允许缓冲液加热至55°C,从而改善核酸单链形式,提升实验结果。
c.运行时间
凝胶长度、所用电压和样品中的分子大小决定电泳所需的时间。通常,电泳会持续到目的条带迁移至凝胶长度的40-60%。凝胶运行的特定时间,可观察到上样染料的相对位置,直至溴酚蓝染料已迁移约60%的凝胶长度和/或橙G染料已迁移80%的凝胶长度。此外,应监测运行时间,以确保样品或标准品中最小的分子不移出凝胶。注意,运行时间过短则不能完全分辨条带(图14)。含有示踪染料的DNA分子量标准可协助监测凝胶的运行,同时也可确保条带不被染料所遮盖。
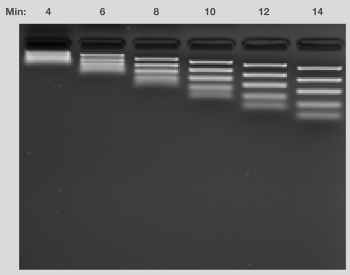
图14.运行时间对样品分离的影响。
4.在凝胶中可视化样品
凝胶运行完成后,需对样品进行可视化分析。由于普通照明环境下,核酸不可见,因此需要一种可视化的检测方法。如表9所述,可用方法在样品检测中,提供了不同的灵敏度和增益范围[6]。
表9.常见的核酸凝胶染色和检测方法。
|
染料 |
优点和注意事项 |
检测灵敏度(近似dsDNA数量) |
|
比色法 |
||
|
亚甲基蓝 结晶紫 |
|
0.5 -1 μg |
|
荧光 |
||
|
EB(溴化乙锭) Invitrogen SYBR安全染料 Invitrogen SYBR绿色染料 Invitrogen SYBR金色染料 |
|
25pg - 1 ng |
|
放射性 |
||
|
32P 33P
3H |
|
10 fg-1 ng |
a.荧光染色
现有的染色剂中,因荧光染料易于使用,灵敏度高,所以在样品检测中应用最为广泛(图15)。 当用适当波长激发时,染料发出可见光(即,荧光)。荧光强度与其和核酸结合的数量有关—这是检测和定量测定电泳中核酸的基础。
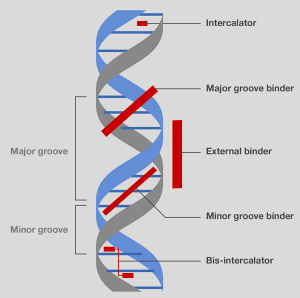
图15.不同类型的核酸结合染料。
溴化乙锭(EtBr) 染色时间短(约30分钟),灵敏度高(可检测到1 ng双链DNA/条带),为核酸电泳中的常用荧光染料。还可考虑另一种染料,原因如下:
-
诱变和处置: 溴化乙锭是高度诱变剂,所以荧光染料的 危险性较小,无需特殊处理,在核酸电泳中可提供安全工作流程(图16)。
-
灵敏度:灵敏度高于EtBr的荧光染料,适合检测少量样品(图16)。 因为有较少的碱基堆积,单链核酸的可视化通常需要更多样品和/或嵌入染料。 因此, 优先结合单链核酸的染料是RNA电泳样品检测的最佳选择。
-
紫外线损害:可用低能量蓝光(而非紫外光)来激发的荧光染料对核酸结构损伤较小,其灵敏度(图17A)不仅相同,甚至更高。 因此,电泳中使用蓝光激发可提高下游的成功应用,如克隆和测序(图17B)。

图16.特性增强的溴化乙锭替代品
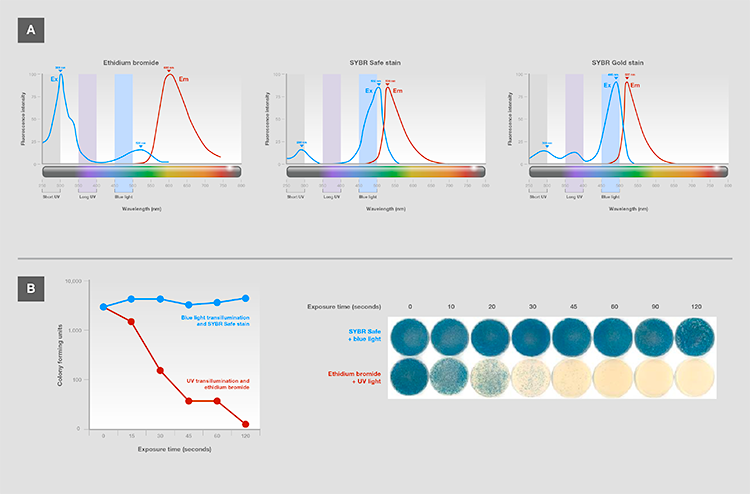
图17.(A)常见核酸染色的激发和发射光谱。最有效的波长被称为激发极大值。SYBR安全与SYBR金染料通过蓝光和较低的紫外光可最大程度激发。(B)用蓝光(针对SYBR安全染料)或紫外光(溴化乙锭)后的克隆效率,用于在电泳过程中显示克隆插入。用x-Gal培养皿上形成的蓝色菌落数量来衡量胶-纯化lacZ片段的克隆效率,其表明已将功能(未突变的)基因插入到载体中。
b.紫外阴影
在染料染色处,可通过称作紫外阴影的方法间接观察核酸,利用核酸[8]来吸收紫外线。该方法通常用于通过电泳分离和纯化寡核苷酸和RNA,这种情况下,简单检测已足够,和/或使用嵌入染料会影响下游的应用。为通过紫外阴影进行检测,需要纳克到微克的样品,并使用薄而透明的凝胶(如聚丙烯酰胺)以确保紫外线的吸收和透射。紫外阴影方法中,电泳后将凝胶从盒中取出(以便最大程度检测),用透明的塑料薄膜包裹后放置在UV-荧光薄层色谱板上。当凝胶至于紫外线辐射下时,核酸条带的吸收会在TLC板上投射阴影(图18)。将所需大小凝胶的阴影部分剪去,以作进一步处理。
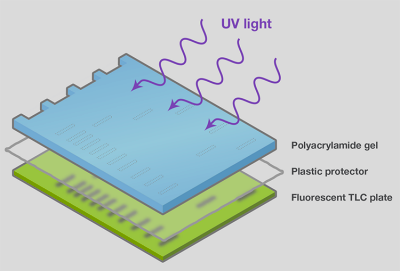
图18.紫外阴影使分离的片段显象。
5.记录凝胶
a.荧光成像技术
可视化后,核酸凝胶通常被存档记录下来,用于记录和分析电泳结果。如果样品被荧光染料染色,需特殊设备以适当的光源激发染料,使其显象并捕捉凝胶图像。激发光源在凝胶上,称为反射照明器(类似于手持式紫外线灯),或在凝胶下,称为透照器 (图19)。由于反射照明器上的光源位置较远,所以样品收到的能量较少。这样可以减少紫外线对核酸的损害,但也会降低凝胶条带的信号。另一方面,透照器可为条带提供更高的信号,但由于辐射接近凝胶,会增加紫外线造成的伤害。
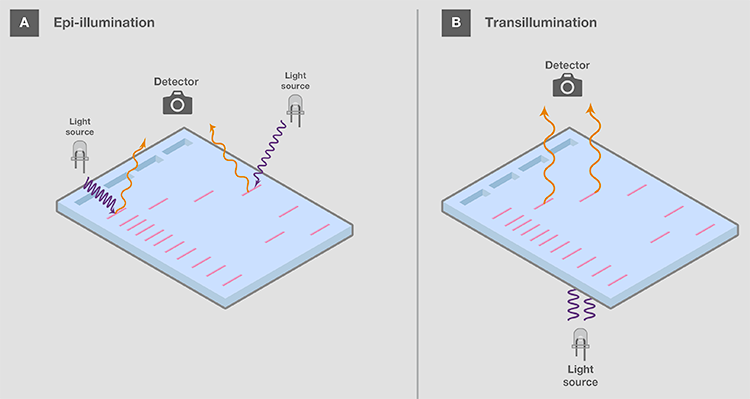
图19.反射照明器和透照器。
b.放射自显影法
在放射性核酸的电泳过程中,凝胶电泳后会暴露在x射线胶片上,这一过程即称为 放射自显影法。条带辐射的强度可用光密度测定来定量。
综上所述,核酸电泳工作流程采用多种步骤和试剂来分离和分析样品。为您的样品选择合适工具,并识别工作流程的优缺点,可显著提高分子生物学应用的电泳结果。
参考文献
1.
2.Green MR, Sambrook J (2012) Analysis of DNA. In:?Molecular Cloning: A Laboratory Manual?(4th ed). Cold Spring Harbor: Cold Spring Harbor Laboratory Press. pp 81–156.
3.
4.
5.
6.
7.
8.